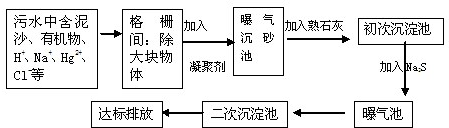
题目内容
14.烟幕弹是一种在战争中常用的掩护武器,制造烟幕弹需要用到一些化学物质.(1)用红磷作烟幕弹时,反应化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5
(2)有些烟幕弹产生烟幕的原理应用了水解反应.水解反应是一类广泛存在的反应,如PCl5、SiCl4易水解.PCl5的水解反应为:PCl5+4H2O=H3PO4+5HCl.现代海战中,常常通过喷放SiCl4和液氨产生大量烟幕,所涉及反应的化学方程式为SiCl4+3H2O+4NH3=H2SiO3+4NH4Cl.
分析 (1)用红磷作烟幕弹时,是红磷在空气中燃烧产生固体五氧化二磷的原故;
(2)喷放SiCl4和液氨产生大量烟幕,根据题中信息可推知SiCl4易水解产生硅酸和盐酸,氨气再与盐酸反应生成固体氯化铵.
解答 解:(1)用红磷作烟幕弹时,是红磷在空气中燃烧产生固体五氧化二磷的原故,反应方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,故答案为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)喷放SiCl4和液氨产生大量烟幕,根据题中信息可推知SiCl4易水解产生硅酸和盐酸,氨气再与盐酸反应生成固体氯化铵,反应方程式为:SiCl4+3H2O+4NH3=H2SiO3+4NH4Cl,故答案为:SiCl4+3H2O+4NH3=H2SiO3+4NH4Cl.
点评 本题考查化学方程式的书写,涉及氧化还原反应、水解反应,灵活运用题中信息是解本题的关键,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验.已知:c(H2SO4)=4.5mol•L-1,反应均需要搅拌60min.
(1)实验①和②的目的是其它条件不变,温度对稀硫酸溶解铝粉量的影响.
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | 20 | 不加 | 20 | 20 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol•L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
2.将下列气体通入水中,既能生成含氧酸,又能生成无氧酸的是( )
| A. | 氯气 | B. | 二氧化氮 | C. | 二氧化碳 | D. | 二氧化硫 |
9.下列叙述正确的是( )
| A. | 元素的单质不能通过氧化含该元素的化合物制得 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只能得到电子被还原,只能作氧化剂 | |
| D. | 含有最高价元素的化合物不一定具有强的氧化性 |
19.pH均为2的HCl和CH3COOH的两种溶液各1L,分别加入足量的Na2CO3粉末,下列说法正确的是( )
| A. | 二者反应的平均速率相等 | B. | 二者溶质的物质的量浓度不相等 | ||
| C. | 二者生成二氧化碳的体积相等 | D. | 二者中氢离子的浓度不相等 |
6.磷元素的原子结构示意图为 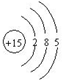 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )
 ,则磷元素位于周期表中( )
,则磷元素位于周期表中( )| A. | 第3周期,第ⅢA族 | B. | 第5周期,第ⅤA族 | C. | 第5周期,第ⅢA族 | D. | 第3周期,第ⅤA族 |
3.若要将0.6mol甲烷完全和氯气发生取代反应,并且生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 1.5 mol | B. | 1.25 mol | C. | 1.6 mol | D. | 2.5 mol |
4.下列反应中,光照对反应几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 次氯酸的分解 | D. | 氢气与氧气的反应 |