题目内容
16.下列实验现象的描述正确的是( )| A. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| B. | 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色 | |
| C. | 铁丝在氯气中燃烧,产生红色的浓烟,产物溶于水,溶液呈浅绿色 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 |
分析 A.氢气在氯气中燃烧生成氯化氢,可形成酸雾;
B.红热的铜丝在氯气中燃烧,产生棕黄色的烟,生成氯化铜溶于水形成蓝色溶液;
C.铁与氯气反应生成棕褐色的氯化铁,氯化铁溶液显示黄色;
D.钠与氯气中燃烧产生白色的烟.
解答 解:A.氢气在氯气中燃烧生成氯化氢,可形成白雾,不会出现烟,故A错误;
B.氯气具有强氧化性,红热的铜丝在氯气中燃烧,生成氯化铜,现象为:产生棕黄色的烟,加入少量水形成蓝色溶液,故B正确;
C.铁与氯气反应生成棕褐色的氯化铁,可发出棕褐色的烟,物溶于水,溶液呈黄色,故C错误;
D.钠与氯气中燃烧产生白色的烟,生成氯化钠白色固体,没有黄色的火焰,故D错误;
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意把握物质的性质、反应现象等,难度不大.

练习册系列答案
相关题目
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有的Cl-数为1NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4LH2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
7.将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/L NaOH溶液中,生成的 NaHCO3和Na2CO3的物质的量之比为( )
| A. | 3:2 | B. | 3:1 | C. | 2:1 | D. | 2:3 |
4.如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是( )
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
| A. | 若a的相对分子质量是42,则d是丙醛 | |
| B. | 若d的相对分子质量是44,则a是乙炔 | |
| C. | 若a为苯乙烯(C6H5-CH=CH2),则f的分子式是C16H16O2 | |
| D. | 若a为单烯烃,则d与f的最简式一定相同 |
8.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 体系的压强不再发生变化 | |
| B. | V正(CO)=V逆(H2O) | |
| C. | 体系的气体的密度和平均相对分子质量不再发生变化 | |
| D. | 1 mol H-H键断裂的同时生成2 mol H-O键 |
3.Ⅰ、实验室里用图1所示的装置制无水CuCl2,根据图示回答下列问题:

(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况: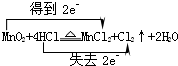 .
.
(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.

(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |