题目内容
1.将6g某金属投入100ml2mol/L的H2SO4溶液中,当H+浓度减少一半时(设溶液体积不变)金属还没有全部溶解,则此金属不可能是( )| A. | Fe | B. | Zn | C. | Mg | D. | Al |
分析 稀硫酸浓度降低,说明金属与稀硫酸反应生成氢气,令金属的相对原子质量为a、反应中化合价为b,消耗一半硫酸时金属有剩余,根据电子转移守恒列不等式,结合选项讨论确定.
解答 解:参加反应的硫酸物质的量=0.1L×2mol/L×$\frac{1}{2}$=0.1mol,令金属的相对原子质量为a、反应后化合价为b,金属还没有全部溶解,根据电子转移守,则$\frac{6}{a}$×b>0.1×2,
A.反应中Fe为+2价,则a<$\frac{6×2}{0.2}$=60,故A符合;
B.反应中Zn为+2价,则应a<$\frac{6×2}{0.2}$=60,而锌的相对原子质量为65,故B不符合;
C.反应后Mg为+2价,则a<$\frac{6×2}{0.2}$=60,故C符合;
D.反应后Al为+3价,则a<$\frac{6×3}{0.2}$=90,故D符合;
故选B.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意利用电子转移守恒方法简化计算,转移讨论法的利用.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
17.《验方新编》中有如下叙述:“凡暑月身热昏沉,未明症候,恐是出丹.用生白扁豆数粒食之.如不知腥味,则以生白扁豆、水泡湿,研汁一小杯,调水一盏服之.即愈”文中涉及的操作方法是( )
| A. | 蒸馏 | B. | 升华 | C. | 浸取 | D. | 分液 |
12.下列叙述中,正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 油脂为高分子化合物 | |
| D. | 符合分子式C5H12的物质有4种 |
16.由氧气与氢气反应生成1mol液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )
| A. | 2H2+O2→2H2O+285.75KJ | B. | 2H2(g)+O2 (g)→2H2O(l)+571.5KJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(g)+285.75KJ | D. | H2(g)+$\frac{1}{2}$O2(g)→H2O(l)-285.75KJ |
6.NaF、NaI、MgO均为离子化合物,现有下列数据,试判断三种化合物的熔点、沸点高低的顺序是
( )
( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子的核间距 | 23.1nm | 31.8nm | 21.0nm |
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
13.现有25mL物质的量浓度相同的三种溶液:①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,下列说法正确的是( )
| A. | 三种溶液pH的大小顺序是③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若三种溶液的pH均为11,则物质的量浓度的大小顺序是③>①>② | |
| D. | 若分别加入25mL等物质的量浓度的盐酸后,pH最大的是① |
10.下列各项中表述正确的是( )
| A. | CO2的分子模型示意图: | B. | F-的离子结构示意图: | ||
| C. | CO2的电子式: | D. | N2的结构式 |
19.下列离子方程式书写正确的是( )
| A. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 氢氧化钠溶液中通入过量的二氧化硫:SO2+OH-=HSO3- | |
| C. | 碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 稀硫酸和氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
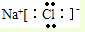 .
.