题目内容
【题目】把35.7g金属锡投入300 mL 14 mol /L HNO3共热(还原产物为NOx),完全反应后测得溶液中c(H+) = 10 mol /L,溶液体积仍为300 mL。放出的气体经水充分吸收,干燥,可得气体8.96 L(S.T.P)。由此推断氧化产物可能是
A.Sn(NO3)4B.Sn(NO3)2C.SnO24H2OD.SnO
【答案】C
【解析】
根据l4mol/LHNO3为浓硝酸,完全反应后测得溶液中的c(H+)=10mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,利用得失电子守恒来分析金属锡被氧化后元素的化合价。
35.7g金属锡的物质的量为![]() =0.3mol,14mol/LHNO3为浓硝酸,完全反应后测得溶液中的c(H+)=10mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,放出的气体经水充分吸收,干燥,可得NO气体8.96 L,根据反应:3NO2+H2O=2HNO3+NO,则标准状况下NO2的物质的量为
=0.3mol,14mol/LHNO3为浓硝酸,完全反应后测得溶液中的c(H+)=10mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,放出的气体经水充分吸收,干燥,可得NO气体8.96 L,根据反应:3NO2+H2O=2HNO3+NO,则标准状况下NO2的物质的量为![]() =1.2mol,设金属锡被氧化后元素的化合价为x,由电子守恒可知,0.3mol×(x0)=1.2mol×(54),解得x=+4,又溶液中c(H+)=10mol/L,而c(NO3)=
=1.2mol,设金属锡被氧化后元素的化合价为x,由电子守恒可知,0.3mol×(x0)=1.2mol×(54),解得x=+4,又溶液中c(H+)=10mol/L,而c(NO3)=![]() =10mol/L,根据溶液电中性可判断氧化产物一定不是硝酸盐,综合以上分析,答案选C。
=10mol/L,根据溶液电中性可判断氧化产物一定不是硝酸盐,综合以上分析,答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
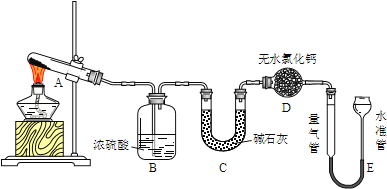
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。