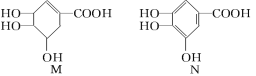题目内容
【题目】某温度下,向2L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)![]() C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率v(A)=0.15 mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的分解率大于80%
D.相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C反应达到平衡前反应速率v(正)<v(逆)
【答案】D
【解析】
A.根据反应速率的定义结合表中数据可知,v(A)=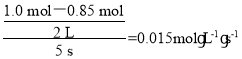 ,A项错误;
,A项错误;
B.升高温度,平衡时剩余A的物质的量为![]() ,说明平衡逆向移动,则正反应为放热反应,ΔH<0,B项错误;
,说明平衡逆向移动,则正反应为放热反应,ΔH<0,B项错误;
C.若加入2molC,假设平衡与题中平衡等效,则C转化率为80%,相当于A、B各加2 mol,与原平衡比相当于加压,平衡向正反应方向移动,C的分解率降低,C项错误;
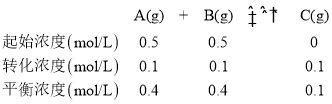
D.根据表中数据,可知,起始时c(A)=c(B)=![]() ,平衡时c(A)=c(B)=
,平衡时c(A)=c(B)= ![]() 。该温度下,利用三段式计算该反应的化学平衡常数:
。该温度下,利用三段式计算该反应的化学平衡常数:
反应的平衡常数为K=![]() ,相同温度下,起始时向容器中充入0.2molA、0.2molB和1.0 molC时,反应的浓度商Q=
,相同温度下,起始时向容器中充入0.2molA、0.2molB和1.0 molC时,反应的浓度商Q=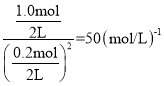 >K,反应向逆反应方向移动,v(正)<v(逆),D项正确。
>K,反应向逆反应方向移动,v(正)<v(逆),D项正确。
答案选D。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
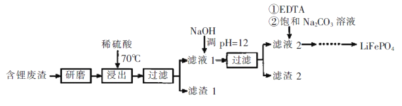
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
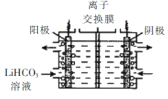
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。