题目内容
18.25℃时,将0.01mol Na2CO3溶于水,形成1L溶液.(1)该溶液中存在着电离和水解情况,用电离方程式或水解方程式表示:
①Na2CO3?2Na++CO32-;
②CO32-+H2O?HCO3-+OH-;
③HCO3-+H2O?H2CO3+OH-;
④H2O?H++OH-.
(2)该溶液中共有7种不同的粒子(指分子和离子).
(3)该溶液显碱性(填“酸”,“碱”或“中”).
分析 Na2CO3溶液中存在Na2CO3和水的电离,Na2CO3为强碱弱酸盐,可水解生成CO32-、HCO3-,溶液呈碱性,以此解答该题.
解答 解:(1)Na2CO3溶液中存在Na2CO3和水的电离,电离方程式分别为Na2CO3?2 Na++CO32-、H2O?H++OH-,Na2CO3为强碱弱酸盐,可水解生成CO32-、HCO3-,存在两步水解,方程式分别为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,
故答案为:①Na2CO3?2 Na++CO32-;②CO32-+H2O?HCO3-+OH-;③HCO3-+H2O?H2CO3+OH-;④H2O?H++OH-;
(2)溶液中存在的分子有H2O、H2CO3,阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,共7种,故答案为:7;
(3)Na2CO3为强碱弱酸盐,水解呈碱性,故答案为:碱.
点评 本题考查溶液中的微粒及电离方程式、水解方程式的书写,为高频考点,题目难度不大,明确溶液中的溶质、电解质的强弱等知识是解答本题的关键.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
9.关于反应11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4的说法正确的是( )
| A. | 既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | 1 mol CuSO4可以氧化$\frac{1}{5}$mol P | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |
13.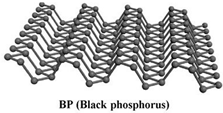 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于高分子化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
10.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
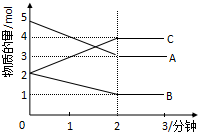 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.