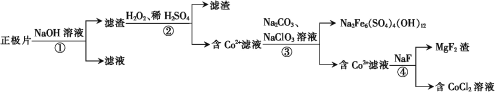
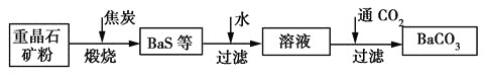
题目内容
【题目】向20mL含有1mol/L的氯化铝溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的物质的量与所加碱的体积如图所示:
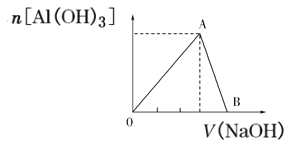
(1)写出OA段和AB段发生反应的离子方程式:OA段_____;AB段_____。
(2)A点溶液中的溶质为:____。(填化学式)
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是____mL或____mL。
(4)B点表示的氢氧化钠溶液的体积是___mL。
【答案】Al3++3OH- =Al(OH)3↓ Al(OH)3+OH- =AlO2-+2H2O NaCl 30mL 70mL 80mL
【解析】
AlCl3溶液中滴加NaOH溶液,Al3++3OH-=Al(OH)3↓,随后生成的沉淀,再溶解,化学方程式为Al(OH)3+OH-=AlO2-+2H2O。
(1)根据分析OA为生成Al(OH)3的阶段,OB段位Al(OH)3溶解的阶段,离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
(2)A点,溶液中的Al3+完全沉淀,溶液中只有Cl-和Na+,则A点溶液中的溶质只有NaCl;
(3)若Al3+完全沉淀,则生成0.02L×1mol·L-1=0.02molAl(OH)3,其质量为0.02mol×78g·mol-1=1.76g,现在产生0.78gAl(OH)3,则有两种情况;
①整个过程中只生成了0.78gAl(OH)3;0.78g Al(OH)3其物质的量为0.01mol,需要消耗0.03molOH-,需要NaOH的体积为0.03mol÷1mol/L=0.03L=30mL;
②Al3+完全沉淀,但是滴入过程的NaOH中,Al(OH)3又溶解了一部分。Al3+完全沉淀,溶液中一共有0.02molAl3+,需要0.06molOH-,共生成0.02molAl(OH)3,再溶解0.01molAl(OH)3,需要0.01molOH-,则整个过程需要0.7molOH-,需要NaOH溶液的体积为0.07mol÷1mol/L=0.07L=70mL;
(4)B点表示的Al3+完全沉淀,沉淀又继续溶解,方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,整个过程的关系式为Al3+~4OH-,溶液中有0.02molAl3+,则需要0.08molOH-,需要NaOH的体积为0.08mol÷1mol/L=0.08L=80mL。