题目内容
【题目】工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为
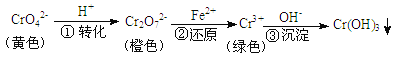
步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)c3(OH-)=10-32,下列有关说法正确的是
A.步骤①中当v(CrO42-)=2v(Cr2O72-)时,说明反应:2CrO42-+2H+ ![]() Cr2O72- +H2O达到平衡状态
Cr2O72- +H2O达到平衡状态
B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由黄色变橙色
C.步骤②中,若要还原1 mol Cr2O72- 离子,需要12 mol的Fe2+
D.步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽
【答案】D
【解析】
A. 步骤![]() 中当
中当![]() 时,说明正逆反应速率相等,各组分浓度不再变化,则反应
时,说明正逆反应速率相等,各组分浓度不再变化,则反应![]() 达到平衡状态,A项错误;
达到平衡状态,A项错误;
B. K2Cr2O7溶液中存在平衡2CrO42-+2H+ ![]() Cr2O72- +H2O,则碱性条件下,
Cr2O72- +H2O,则碱性条件下,![]() 橙色
橙色![]() 会转化成
会转化成![]() 黄色
黄色![]() ,溶液可由橙色变黄色,B项错误;
,溶液可由橙色变黄色,B项错误;
C. 还原![]() 离子,转移电子为
离子,转移电子为![]() ,Fe元素的化合价由
,Fe元素的化合价由![]() 升高为
升高为![]() ,则由得失电子守恒可知需要6mol的Fe2+,C项错误;
,则由得失电子守恒可知需要6mol的Fe2+,C项错误;
D. 步骤![]() 中,当将溶液的pH调节至5时,
中,当将溶液的pH调节至5时,![]() ,由Ksp可知,
,由Ksp可知, ,则可认为废水中的铬元素已基本除尽,D项正确;
,则可认为废水中的铬元素已基本除尽,D项正确;
答案选D。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
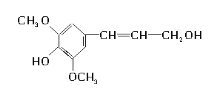
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
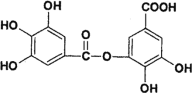
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。