��Ŀ����
�ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�죮�ϳɰ���Ӧ�Ļ�ѧ����ʽΪ��N2��g��+3H2��g�� 2������NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã�
2������NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã�
��1����һ�ݻ��̶����ܱ�������ע��N2��H2�������壬����������Ӧ����ij�¶��´ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc��H2��=9.00mol/L��c��N2��=3.00mol/L��c��NH3��=4.00mol/L�����¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ______��
��2��������ͬ�����и�����1molN2��3molH2���ڲ�ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��ı仯��ͼ��ʾ������˵����ȷ����______������ţ���
A��ͼI�����Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2
C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
D��ͼ��һ������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ���Ч��1��2
��3����ˮ����ͨ�����ȵ�̿������ˮ��������ѧ����ʽΪ��C��s��+H2O��g��
 H2��g��+CO��g����H=+131.3kJ����S=+133.7J/K�÷�Ӧ�ڵ������ܷ��Է�______����ܻ��
H2��g��+CO��g����H=+131.3kJ����S=+133.7J/K�÷�Ӧ�ڵ������ܷ��Է�______����ܻ����4�������ڸ�������ˮ������Ӧ��Ӧ����ʽΪ��CH4��g��+H2O��g��=CO��g��+3H2��g�����������ʵ�ȼ�����������±���
| �� �� | ȼ���� |
| H2��g�� | -285.8 |
| CO��g�� | -283.0 |
| CH4��g�� | -890.3 |
��5����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl-NH4ClΪ�������Һ��ȡ����ȼ�ϵ�أ���д���õ�ص�������Ӧʽ______��
���𰸡���������1������k= ����ƽ�ⳣ����
����ƽ�ⳣ����
��2���������������ƽ���ƶ���Ӱ�������
��3���ж��������Ƿ�С��0�����жϷ�Ӧ�ܷ��Է����У�
��4�����ݸ���Ӧ���Ȼ�ѧ����ʽ�����ø�˹���ɼ��㣻
��5������ԭ�������������ԭ��Ӧ��д��
����⣺��1��k= =
= =7.32×10-3���ʴ�Ϊ��7.32×10-3��
=7.32×10-3���ʴ�Ϊ��7.32×10-3��
��2��A������ѹǿ��ƽ��������Ӧ�����ƶ��������ĺ�������A����
B��ͼ��Ӧ�Ǵ����Է�Ӧ��Ӱ�죬��B����
C���¶����ߣ�ƽ�����淴Ӧ�����ƶ��������ĺ������ͣ���C����
D��ͼ��������;��ƽ��״̬��ͬ��Ӧ�Ǵ�����ƽ���Ӱ�죬1��Ӧ���ʴ�Ч���ã���D��ȷ��
�ʴ�Ϊ��D��
��3����G=��H-T?��S=131.3kJ-T×133.7kJ×10-3�����¶Ƚϵ�ʱ����G��0�������Է����У�
�ʴ�Ϊ����
��4���ɱ������ݿ�֪����H2��g��+ O2��g��=H2O��l����H=-285.8kJ?mol-1��
O2��g��=H2O��l����H=-285.8kJ?mol-1��
��CO��g��+ O2��g��=CO2��g����H=-283.0 kJ?mol-1��
O2��g��=CO2��g����H=-283.0 kJ?mol-1��
��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3 kJ?mol-1��
��H2O��g��=H2O��l����H=-44.0kJ?mol-1��
���ø�˹���ɣ�����+��-��×3-�ڿɵã�CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
�ʴ�Ϊ��CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
��5��ԭ�������������ԭ��Ӧ��N2�õ�������NH4+���缫��ӦʽΪN2+6e-+8H+=2NH4+��
�ʴ�Ϊ��N2+6e-+8H+=2NH4+��
���������⿼���Ϊ�ۺϣ��漰��ѧƽ�⣬��ѧ��Ӧ�������Լ��绯ѧ֪ʶ����Ŀ�ѶȽϴ���ע��缫��Ӧʽ����д��ע�����ø�˹���ɼ��㷴Ӧ�ȵķ�����
 ����ƽ�ⳣ����
����ƽ�ⳣ������2���������������ƽ���ƶ���Ӱ�������
��3���ж��������Ƿ�С��0�����жϷ�Ӧ�ܷ��Է����У�
��4�����ݸ���Ӧ���Ȼ�ѧ����ʽ�����ø�˹���ɼ��㣻
��5������ԭ�������������ԭ��Ӧ��д��
����⣺��1��k=
 =
= =7.32×10-3���ʴ�Ϊ��7.32×10-3��
=7.32×10-3���ʴ�Ϊ��7.32×10-3����2��A������ѹǿ��ƽ��������Ӧ�����ƶ��������ĺ�������A����
B��ͼ��Ӧ�Ǵ����Է�Ӧ��Ӱ�죬��B����
C���¶����ߣ�ƽ�����淴Ӧ�����ƶ��������ĺ������ͣ���C����
D��ͼ��������;��ƽ��״̬��ͬ��Ӧ�Ǵ�����ƽ���Ӱ�죬1��Ӧ���ʴ�Ч���ã���D��ȷ��
�ʴ�Ϊ��D��
��3����G=��H-T?��S=131.3kJ-T×133.7kJ×10-3�����¶Ƚϵ�ʱ����G��0�������Է����У�
�ʴ�Ϊ����
��4���ɱ������ݿ�֪����H2��g��+
 O2��g��=H2O��l����H=-285.8kJ?mol-1��
O2��g��=H2O��l����H=-285.8kJ?mol-1����CO��g��+
 O2��g��=CO2��g����H=-283.0 kJ?mol-1��
O2��g��=CO2��g����H=-283.0 kJ?mol-1����CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3 kJ?mol-1��
��H2O��g��=H2O��l����H=-44.0kJ?mol-1��
���ø�˹���ɣ�����+��-��×3-�ڿɵã�CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
�ʴ�Ϊ��CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1 kJ?mol-1��
��5��ԭ�������������ԭ��Ӧ��N2�õ�������NH4+���缫��ӦʽΪN2+6e-+8H+=2NH4+��
�ʴ�Ϊ��N2+6e-+8H+=2NH4+��
���������⿼���Ϊ�ۺϣ��漰��ѧƽ�⣬��ѧ��Ӧ�������Լ��绯ѧ֪ʶ����Ŀ�ѶȽϴ���ע��缫��Ӧʽ����д��ע�����ø�˹���ɼ��㷴Ӧ�ȵķ�����

��ϰ��ϵ�д�
�����Ŀ
 3NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã��ҹ��ϳɰ���ҵĿǰ����������Ϊ������-����ý���¶�-400��500�棬ѹǿ-30��50MPa��
3NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã��ҹ��ϳɰ���ҵĿǰ����������Ϊ������-����ý���¶�-400��500�棬ѹǿ-30��50MPa��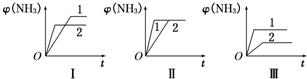
 2������NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã�
2������NH3��g����H=-92.2kJ/mol���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����ڸ�������ˮ������Ӧ�Ƶã�
 H2��g��+CO��g����H=+131.3kJ����S=+133.7J/K�÷�Ӧ�ڵ������ܷ��Է�
H2��g��+CO��g����H=+131.3kJ����S=+133.7J/K�÷�Ӧ�ڵ������ܷ��Է�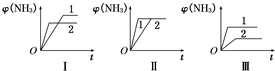 �ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�죮�ϳɰ���Ӧ�Ļ�ѧ����ʽΪN2��g��+3H2��g��?2NH3��g����H=-92.2kJ?mol-1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶã�
�ϳɰ����������Ĵ����������˹��̵���;�����Ի�ѧ��ҵ����Ҳ�������ش�Ӱ�죮�ϳɰ���Ӧ�Ļ�ѧ����ʽΪN2��g��+3H2��g��?2NH3��g����H=-92.2kJ?mol-1���ϳɰ���ҵ��ԭ����N2�ɴӿ����з���õ���H2���ü����̿��ˮ������Ӧ�Ƶã�