题目内容
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈________性(填“酸”、“中”或“碱”),原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________,原因是________________________________________________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为_______________________________。
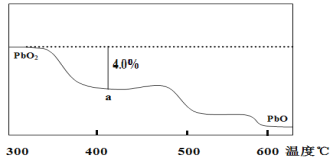
(4)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
【答案】酸 Fe3++3H2O ![]() Fe(OH)3+3H+ Fe2O3 FeCl3水解生成Fe(OH)3和盐酸,盐酸挥发,水蒸发,灼烧时氢氧化铁分解生成Fe2O3 = ④>①>②>③ Pb-2e-+SO42-=PbSO4 32 MgO(或Mg(OH)2、MgCO3等) 4×10-8 mol·L-1 1.2×10-4
Fe(OH)3+3H+ Fe2O3 FeCl3水解生成Fe(OH)3和盐酸,盐酸挥发,水蒸发,灼烧时氢氧化铁分解生成Fe2O3 = ④>①>②>③ Pb-2e-+SO42-=PbSO4 32 MgO(或Mg(OH)2、MgCO3等) 4×10-8 mol·L-1 1.2×10-4
【解析】
(1)FeCl3为强酸弱碱盐,呈酸性,其原因是Fe3++3H2O ![]() Fe(OH)3+3H+;FeCl3溶液水解生成Fe(OH)3和盐酸,加热,盐酸挥发,水蒸发,水解平衡正向移动,最后得到Fe(OH)3,灼烧后2Fe(OH)3
Fe(OH)3+3H+;FeCl3溶液水解生成Fe(OH)3和盐酸,加热,盐酸挥发,水蒸发,水解平衡正向移动,最后得到Fe(OH)3,灼烧后2Fe(OH)3![]() Fe2O3+3H2O,所以最后得到固体产物是Fe2O3; 故答案为:酸;Fe3++3H2O
Fe2O3+3H2O,所以最后得到固体产物是Fe2O3; 故答案为:酸;Fe3++3H2O ![]() Fe(OH)3+3H+;Fe2O3; FeCl3水解生成Fe(OH)3和盐酸,盐酸挥发,水蒸发,灼烧时氢氧化铁分解生成Fe2O3;
Fe(OH)3+3H+;Fe2O3; FeCl3水解生成Fe(OH)3和盐酸,盐酸挥发,水蒸发,灼烧时氢氧化铁分解生成Fe2O3;
(2)0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,则混合溶液的溶质为:0.05 mol·L-1HA和0.05 mol·L-1NaA,测得混合溶液中c(Na+)>c(A-),则A-水解程度大于HA的电离程度,溶液显碱性,根据物料守恒,c(HA)+c(A-)=0.1 mol·L-1;故答案为:=;
(3)①氯化铵溶液中,氯离子对铵根离子的水解无影响;②碳酸氢铵溶液中,碳酸氢根离子促进铵根离子水解;③氨水微弱电离出铵根离子和氢氧根离子;④硫酸氢铵中,氢离子抑制铵根离子的水解,所以NH4+浓度由大到小的顺序为:④>①>②>③;故答案为:④>①>②>③;
(4)根据电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O可知,放电时,Pb作负极,PbO2作正极,负极的电极反应式为:Pb-2e-+SO42-=PbSO4,充电时,原负极板发生反应为:PbSO4+2e-=Pb+SO42-,原正极板发生反应为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,电路通过2mol电子时,理论上正极板的质量减少64g,电路通过1mol电子时,理论上正极板的质量减少32g;故答案为:Pb-2e-+SO42-=PbSO4;32;
2PbSO4+2H2O可知,放电时,Pb作负极,PbO2作正极,负极的电极反应式为:Pb-2e-+SO42-=PbSO4,充电时,原负极板发生反应为:PbSO4+2e-=Pb+SO42-,原正极板发生反应为:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,电路通过2mol电子时,理论上正极板的质量减少64g,电路通过1mol电子时,理论上正极板的质量减少32g;故答案为:Pb-2e-+SO42-=PbSO4;32;
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①为得到纯净的MgCl2·2H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为MgCl2,所以应该加入含Mg元素的物质,可以是MgO(或Mg(OH)2、MgCO3等),调节溶液的pH=4,溶液中c(H+)=10-4 mol·L-1, c(OH-)=10-10 mol·L-1,使溶液中的Fe3+转化为Fe(OH)3沉淀,c(Fe3+)=![]() mol·L-1;故答案为:
mol·L-1;故答案为: ;
;
②等体积混合浓度减半,c(Mg2+)=0.005 mol·L-1,![]() =1.8×10-11,c(OH-)=6×10-5,所以NaOH溶液的浓度为6×2×10-4=1.2×10-4mol·L-1;故答案为:1.2×10-4。
=1.8×10-11,c(OH-)=6×10-5,所以NaOH溶液的浓度为6×2×10-4=1.2×10-4mol·L-1;故答案为:1.2×10-4。

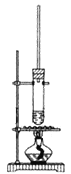
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理及装置示意图(加热、 夹持及辅助仪器省略)和一些相关信息如下:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | ﹣95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
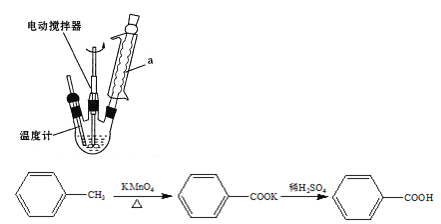
Ⅰ.在b 中加入 2.7 mL 甲苯、100 mL水和几片碎瓷片,开动电动搅拌器,a中通水。将b 中的液体加热至沸腾,分批加入 8.5 g 高锰酸钾,继续搅拌约5 h,停止加热和搅拌,静置。
Ⅱ.在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,再用浓盐酸酸化,苯甲酸全部析出后减压过滤,冷水洗涤,干燥,得到粗产品。
Ⅲ.称取m g产品,配成 100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。请回答下列问题:
(1)装置a的作用___________
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用_______,请用离子方式表示该反应原理_____。
(3)产品减压过滤时用冷水洗涤的原因是_____________
(4)选用下列________(选填字母)操作,可以将粗产品进一步提纯。
A 溶于水后过滤 B 溶于乙醇后蒸馏
C 用甲苯萃取后分液 D 升华
(5)测定纯度步骤中,滴定终点溶液的颜色变化是__。若m=1.200 g,滴定时用去0.1200 mol·L-1 标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为______。