��Ŀ����
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ���������ѧ֪ʶ�ش��������⣺
��1��д����ʾ����8�����ӡ�10�����ӵ�ԭ�ӵĻ�ѧ����________��
��2����д���������ʵĵ���ʽ��
CO2________�� Na2O2________��
��3�����õ���ʽ��ʾNaCl���γɹ���___________��
��4����д����4���ڢ�AԪ�ض�Ӧ�����ӽṹʾ��ͼ_____��
��5������ѧ�������û���Ӧ���û���Ӧ��ͨʽ���Ա�ʾΪ�����ʣ�A���������B���������A�������ʣ�B������д����������Ҫ���3���û���Ӧ�Ļ�ѧ����ʽ�������漰��Ԫ�ؾ�Ϊ�����ڣ���6�ֵ��ʷ���6����ͬ�����塣______
���𰸡�![]() O
O ![]()
![]()
![]()
 2Mg+CO2
2Mg+CO2 2MgO+C��2Al+6HCl=2AlCl3+3H2����2F2+2H2O=4HF+O2
2MgO+C��2Al+6HCl=2AlCl3+3H2����2F2+2H2O=4HF+O2
��������
(1)����8�����ӡ�10�����ӵ�ԭ����������=������+������=10+8=18��������Ϊ8��Ϊ��Ԫ�أ���ѧ����Ϊ![]() O��
O��
(2)CO2Ϊ���ۻ����ÿ��Oԭ����̼ԭ�ӹ������Ե��ӣ�����ʽΪ![]() ��Na2O2Ϊ���ӻ���������ʽΪ
��Na2O2Ϊ���ӻ���������ʽΪ![]() ��
��
(3)��ԭ�ӵõ�һ�������γ������ӣ���ԭ��ʧȥһ�������γ������ӣ����������������γ��Ȼ��ƣ��γɹ���Ϊ![]() ��
��
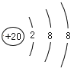
(4)��4������AԪ��Ϊ20��Ԫ��Ca��ʧȥ�����������ɸ����ӣ����ӽṹʾ��ͼΪ ��
��
(5)�����û���Ӧ���ص��Լ��μӷ�Ӧ��Ԫ�ص�Ҫ����û���Ӧ�ĸ���ó����������ķ�Ӧ�����ǣ�2Mg+CO2 2MgO+C��2Al+6HCl=2AlCl3+3H2����2F2+2H2O=4HF+O2��
2MgO+C��2Al+6HCl=2AlCl3+3H2����2F2+2H2O=4HF+O2��

 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�����Ŀ����NaΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 =a kJ mol -1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 =bkJ mol-1
���ܶ��壺�ڱ�״���£���1 mol��̬����AB(g)����Ϊ��̬ԭ��
A(g)��B(g)�������������֪1 mol�����ļ���ΪxkJ�������������� ����ʾ������˵����ȷ����
��ѧ�� | C��O | C��H | O��H |
����/(kJ mol-1) | 798 | 413 | 463 |
A.������x=![]()
B.H2O(g) = H2O(1)����S<0����H=(a �� b) kJ mol -1
C.����4NA��O��H������ʱ����Ӧ�ų�������Ϊa kJ
D.���÷�Ӧ����Ƶ�ԭ��ص�⾫��ͭ�����������0.2NA������ʱ. �����ϵ��۵�������������6.4 g