题目内容
二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2 ,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________ ;
②检验TiO2·x H2O中Cl-是否被除净的方法是______________________________
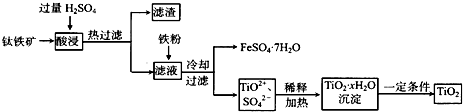
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
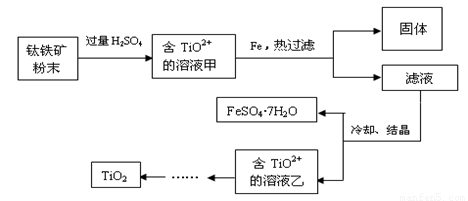
(2)钛铁矿粉末中加硫酸反应得TiO2+的离子方程式为
(3)溶液甲中加入Fe的作用是
(4)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是
Ⅱ二氧化钛可用于制取钛单质,涉及到的步骤如下图:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因: _
Ⅰ(1)① TiCl4+ (x+2)H2O =TiO2·x H2O+ 4HCl
②取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加硝酸酸化的AgNO3溶液,若无白色沉淀产生,则表明沉淀已洗涤干净。
(2)FeTiO3+ 4H+ = TiO2 + +Fe2+ + 2H2O
(3)将溶液中的Fe3+还原为Fe2+
(4)坩埚 泥三角
ⅡTiCl4+2Mg=2MgCl2+Ti 防止高温下Mg(Ti)与空气中的氧气(或CO2、N2)作用)
【解析】
试题分析::(1)①设TiCl4的系数为1,根据元素守恒,TiO2•xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),方程式为TiCl4+(x+2)H2O⇌TiO2•xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O⇌TiO2•xH2O↓+4HCl;②沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净;(2)根据氧化还原原理,钛铁矿粉末中加硫酸反应得TiO2+的离子方程式为Fe2O3+6H+=2Fe3++3H2O,FeTiO3+4H+=Fe2++TiO2++2H2O;(3)该溶液中含有铁离子,铁具有还原性,能将铁离子氧化生成亚铁离子且不引进新的杂质,所以铁的作用是:将Fe3+转化为Fe2+,故答案为:将Fe3+转化为Fe2+;(4)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是坩埚和泥三角。在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,反应方程式为:TiCl4+2Mg=2MgCl2+Ti。Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,故答案为TiCl4+2Mg=2MgCl2+Ti; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用。
考点:考查学生对工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力。