题目内容
【题目】硫酸亚铁铵![]() 是一种重要的化学试剂,某兴趣小组在课本合成方案的基础上进行了改进,流程如下:
是一种重要的化学试剂,某兴趣小组在课本合成方案的基础上进行了改进,流程如下:

(1)下列说法正确的是_________。
A.废铁屑需用![]() 溶液除去表面的油污,通常采用抽滤除去碱液
溶液除去表面的油污,通常采用抽滤除去碱液
B.实验中使用的蒸馏水均需煮沸除氧
C.在加入硫酸铵前,应该把硫酸亚铁溶液的pH值控制在强酸性范围内
D.鉴定所得晶体中含有![]() ,可以取少量样品于试管中,加水溶解,加入NaOH溶液,露置于空气中,观察现象
,可以取少量样品于试管中,加水溶解,加入NaOH溶液,露置于空气中,观察现象

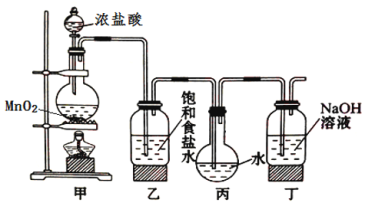
(2)废铁屑含有碳、硫、硅等杂质,为较快地制得较纯净的![]() ,该兴趣小组设计图甲装置来制备产品,并选用了以下试剂中的一部分来完成实验。
,该兴趣小组设计图甲装置来制备产品,并选用了以下试剂中的一部分来完成实验。
a.![]() 溶液 b.碳粉 c.
溶液 b.碳粉 c.![]() 溶液 e.
溶液 e.![]() 溶液 f.乙醇
溶液 f.乙醇
①在去油污后的废铁屑中加入一种物质,该物质可以为_________。
②在洗气瓶中装入一种物质,该物质可以为_________。
(3)步骤Ⅲ的具体操作:迅速取滤液置于容器中,沿器壁缓慢加入适量乙醇,使之覆盖在液面上,随着乙醇在溶液中不断扩散,硫酸亚铁铵逐渐结晶析出。该方法的优点是(写出至少两点)_________。
(4)制得![]() 后,需要对晶体进行干燥,课本用干净的滤纸吸干,该兴趣小组同学经过讨论,决定用减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须__________________,然后启盖。
后,需要对晶体进行干燥,课本用干净的滤纸吸干,该兴趣小组同学经过讨论,决定用减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须__________________,然后启盖。
(5)产品中铁含量的测定可以采用酸性高锰酸钾滴定的方法。高锰酸钾标准溶液可用性质稳定,摩尔质量较大的基准物质草酸钠进行标定,反应原理为:
![]() 。
。
实验步骤如下:
步骤一:先粗配浓度约为![]() 的高锰酸钾溶液250mL;
的高锰酸钾溶液250mL;
步骤二:称取草酸钠固体m g放入锥形瓶中,加入适量水溶解并加硫酸酸化,加热到![]() ,立即用
,立即用![]() 滴定,从而标定
滴定,从而标定![]() 浓度为
浓度为![]() ;
;
步骤三:称取样品2.031g,放入锥形瓶并用适量水溶解;
步骤四:用标准![]() 溶液滴定步骤三所配样品溶液,达到终点时消耗标准液45.00mL.
溶液滴定步骤三所配样品溶液,达到终点时消耗标准液45.00mL.
①步骤一中至少需要用到的玻璃仪器有烧杯、___________、___________。
②步骤二中需要对m的值进行预估,你的预估依据是____________。
a.所加硫酸的体积和浓度 b.反应的定量关系
c.滴定管的最大容量 d.用于溶解草酸钠的水的体积
③实验过程中需要进行多次滴定,在滴定步骤前要进行一系列操作,请选择合适的编号,按正确的顺序排列____________。
a.向酸式滴定管中间装入操作液至“0”刻度以上;
b.用蒸馏水洗涤滴定管;
c.将滴定管内装满水,直立于滴定管夹上约2min;
d.用操作溶液润洗滴定管;
e.将活塞旋转![]() 后,再次观察;
后,再次观察;
f.将滴定管直立于滴定管夹上,静置Ⅰ分钟左右,读数;
g.右手拿住滴定管使其倾斜![]() ,左手迅速打开活塞。
,左手迅速打开活塞。
【答案】ABCD c f 防止硫酸亚铁铵被空气氧化;可防止其水解 打开阀门A 250mL容量瓶 玻璃棒(或胶头滴管) bc cebdagf
【解析】
(1)A. ![]() 溶液呈碱性,油脂可在碱性环境水解;
溶液呈碱性,油脂可在碱性环境水解;
B.实验中使用的蒸馏水均需煮沸除氧,防止Fe2+被氧化
C.控制硫酸亚铁溶液的pH值防止水解;
D.鉴定所得晶体中含有![]() ,可以取少量样品于试管中,加水溶解,加入NaOH溶液,生成白色沉淀逐渐转变为红褐色;
,可以取少量样品于试管中,加水溶解,加入NaOH溶液,生成白色沉淀逐渐转变为红褐色;
(2)在去油污后的废铁屑中可加入硫酸铜,与铁反应生成铜单质形成原电池加快反应速率;硫酸亚铁不溶于乙醇,可用乙醇使其沉淀;
(3)乙醇密度较小覆盖在表面可隔绝空气防止硫酸亚铁铵被空气氧化,不采用加热浓缩、冷却结晶可防止其水解;
(4)减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须先打开阀门A,确保其内外气压一致;
(5)①溶液配制需要用到玻璃仪器有250mL容量瓶,玻璃棒,烧杯,胶头滴管;
②滴定时需要对m的值进行预估,预估依据为反应的定量关系,滴定管的最大容量;
③滴定管滴定步骤前要检漏-洗涤-润洗-注液-调液-读数。
(1)A. ![]() 溶液呈碱性,油脂可在碱性环境水解,除去
溶液呈碱性,油脂可在碱性环境水解,除去![]() 溶液可以抽滤,故A正确;
溶液可以抽滤,故A正确;
B.实验中使用的蒸馏水均需煮沸除氧,防止Fe2+被氧化,故B正确;
C.控制硫酸亚铁溶液的pH值防止水解;故C正确;
D.鉴定所得晶体中含有![]() ,可以取少量样品于试管中,加水溶解,加入NaOH溶液,生成白色沉淀逐渐转变为红褐色;故D正确;
,可以取少量样品于试管中,加水溶解,加入NaOH溶液,生成白色沉淀逐渐转变为红褐色;故D正确;
故答案选:ABCD。
(2)在去油污后的废铁屑中可加入硫酸铜,与铁反应生成铜单质形成原电池加快反应速率;硫酸亚铁不溶于乙醇,可用乙醇使其沉淀,防止其氧化;故答案为:c;f;
(3)乙醇密度较小覆盖在表面可隔绝空气防止硫酸亚铁铵被空气氧化,不采用加热浓缩、冷却结晶可防止其水解;故答案为:防止硫酸亚铁铵被空气氧化;可防止其水解;
(4)减压干燥,装置如图乙所示。将产品放入干燥器后、用水泵抽至盖子推不动即可。干燥结束后,启盖前,必须先打开阀门A,确保其内外气压一致,故答案为:打开阀门A;
(5)①溶液配制需要用到玻璃仪器有250mL容量瓶,玻璃棒,烧杯,胶头滴管;故答案为250mL容量瓶;玻璃棒(或胶头滴管);
②滴定时需要对m的值进行预估,预估依据为反应的定量关系,滴定管的最大容量;故答案为:bc;
③滴定管滴定步骤前要检漏-洗涤-润洗-注液-调液-读数。故答案为:cebdagf。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%