题目内容
(1)、写出下列有关反应的离子方程式或化学方程式
①氢氧化铝[Al(OH)3]制成的药片制胃病:
②铝热反应用于焊接钢轨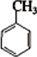 +3HNO3
+3HNO3
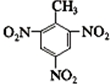 +3H2O
+3H2O +3HNO3
+3HNO3
 +3H2O
+3H2O
④乙烯生产聚乙烯
(2)、铝片与过量的稀硫酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
①升高温度②加入适量的水③加入少量CuSO4④把稀硫酸换成浓硫酸⑤把铝片粉碎⑥加入NaNO3溶液⑦加入少量氢氧化钠溶液.
①氢氧化铝[Al(OH)3]制成的药片制胃病:
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
②铝热反应用于焊接钢轨
3Fe3O4+8Al
4Al2O3+9Fe
| ||
3Fe3O4+8Al
4Al2O3+9Fe
③甲苯在浓硫酸、加热的条件下生成炸药TNT
| ||
 +3HNO3
+3HNO3
| ||
| △ |
 +3H2O
+3H2O +3HNO3
+3HNO3
| ||
| △ |
 +3H2O
+3H2O④乙烯生产聚乙烯
nCH2═CH2
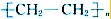 ;
;
| 引发剂 |
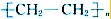 ;
;nCH2═CH2
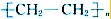 ;
;
| 引发剂 |
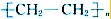 ;
;(2)、铝片与过量的稀硫酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
①③⑤
①③⑤
①升高温度②加入适量的水③加入少量CuSO4④把稀硫酸换成浓硫酸⑤把铝片粉碎⑥加入NaNO3溶液⑦加入少量氢氧化钠溶液.
分析:(1)①氢氧化铝属于碱,能和酸反应生成盐和水;
②铝热反应是金属铝置换其他金属的反应;
③甲苯中苯环上甲基的临位和对位氢易被取代;
④乙烯能发生加聚反应生成聚乙烯;
(2)根据影响化学反应速率的因素:温度、浓度、压强、催化剂、固体表面积等方面来回答.
②铝热反应是金属铝置换其他金属的反应;
③甲苯中苯环上甲基的临位和对位氢易被取代;
④乙烯能发生加聚反应生成聚乙烯;
(2)根据影响化学反应速率的因素:温度、浓度、压强、催化剂、固体表面积等方面来回答.
解答:解:(1)①氢氧化铝属于碱,能和胃酸盐酸反应生成氯化铝和水,实质是:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
②铝热反应是金属铝置换氧化铁中的铁的反应,可以用于焊接钢轨,即3Fe3O4+8Al
4Al2O3+9Fe,
故答案为:3Fe3O4+8Al
4Al2O3+9Fe;
③甲苯在浓硫酸和浓硝酸的作用下,其中苯环上甲基的临位和对位氢易被硝基取代,即 +3HNO3
+3HNO3
 +3H2O,
+3H2O,
故答案为: +3HNO3
+3HNO3
 +3H2O;
+3H2O;
④乙烯能发生加聚反应生成聚乙烯塑料,原理是:nCH2═CH2
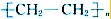 ,
,
故答案为:nCH2═CH2
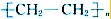 ;
;
(2)①温度升高,反应速率加快,故①正确;
②加入适量的水相当于把酸稀释,氢离子浓度减小,反应速率减慢,故②错误;
③加入少量CuSO4,形成了铝、铜、稀硫酸原电池,反应速率加快,故③正确;
④金属铝和浓硫酸在常温下钝化,故④错误;
⑤增大固体的接触面积,可以加快反应速率,故⑤正确;
⑥加入NaNO3溶液相当于加水把酸稀释,氢离子浓度减小,反应速率减慢,故⑥错误;
⑦加氢氧化钠溶液,金属铝和氢氧化钠反应也会产生氢气,这样最终生成氢气的量增加,即影响生成的氢气总量,故⑦错误.
故选①③⑤.
故答案为:Al(OH)3+3H+=Al3++3H2O;
②铝热反应是金属铝置换氧化铁中的铁的反应,可以用于焊接钢轨,即3Fe3O4+8Al
| ||
故答案为:3Fe3O4+8Al
| ||
③甲苯在浓硫酸和浓硝酸的作用下,其中苯环上甲基的临位和对位氢易被硝基取代,即
 +3HNO3
+3HNO3
| ||
| △ |
 +3H2O,
+3H2O,故答案为:
 +3HNO3
+3HNO3
| ||
| △ |
 +3H2O;
+3H2O;④乙烯能发生加聚反应生成聚乙烯塑料,原理是:nCH2═CH2
| 引发剂 |
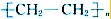 ,
,故答案为:nCH2═CH2
| 引发剂 |
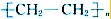 ;
;(2)①温度升高,反应速率加快,故①正确;
②加入适量的水相当于把酸稀释,氢离子浓度减小,反应速率减慢,故②错误;
③加入少量CuSO4,形成了铝、铜、稀硫酸原电池,反应速率加快,故③正确;
④金属铝和浓硫酸在常温下钝化,故④错误;
⑤增大固体的接触面积,可以加快反应速率,故⑤正确;
⑥加入NaNO3溶液相当于加水把酸稀释,氢离子浓度减小,反应速率减慢,故⑥错误;
⑦加氢氧化钠溶液,金属铝和氢氧化钠反应也会产生氢气,这样最终生成氢气的量增加,即影响生成的氢气总量,故⑦错误.
故选①③⑤.
点评:本题考查学生物质的性质以及方程式的书写和影响化学反应速率的因素知识,要求学生熟记教材知识,灵活运用.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目