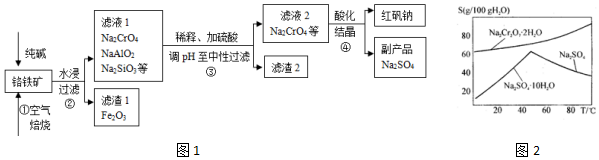
题目内容
9.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使酚酞变红色的溶液:NH4+,Ca2+,NO3-,Cl- | |
| B. | c(OH-)=1×10-13mol•L-1的溶液:Na+,K-,ClO-,SO42- | |
| C. | 0.1mol•L-1的FeCl2溶液:K+,Na+,SO42-,Br- | |
| D. | 0.1mol•L-1的酸性KMnO4溶液:Na+,Mg2+,NO3-,SO32- |
分析 A.使酚酞变红色的溶液呈碱性;
B.c(OH-)=1×10-13mol•L-1的溶液呈酸性;
C.离子之间不发生任何反应;
D.与MnO4-反应的离子不能大量共存.
解答 解:A.使酚酞变红色的溶液呈碱性,NH4+不能大量共存,故A错误;
B.c(OH-)=1×10-13mol•L-1的溶液呈酸性,ClO-不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.SO32-与MnO4-发生氧化还原反应而不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高考高频考点,侧重氧化还原反应的离子共存问题的考查,注意信息的抽取和应用,选项D为解答的难点,题目难度中等

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
19.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | SO2、SiO2、CO、P2O5都是非金属元素形成的氧化物,均为酸性氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 有色玻璃、稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| D. | HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质 |
20.用ClO2溶液处理含NaCN的废水的反应原理为:5NaCN+2ClO2+11H2O=5NaHCO3+3NH3↑+2NH4Cl,已知HCN的酸性比H2CO3弱.下列有关说法正确的是( )
| A. | 该反应中ClO2作氧化剂,NaCN中氮元素被氧化 | |
| B. | 常温下NaHCO3的水溶液呈酸性 | |
| C. | 0.1mol/L的NaCN溶液中c(CN-)为0.1mol/L | |
| D. | 每消耗1mol ClO2,该反应转移5mole- |
17.下列离子方程式书写不正确的是( )
| A. | 碳酸钠与次氯酸反应:CO32-+2HClO═2ClO-+H2O+CO2↑ | |
| B. | 二氧化硫通入次氯酸钠溶液中:SO2+ClO-+2OH-═SO42-+Cl-+H2O | |
| C. | 明矾溶液中加氢氧化钡溶液至硫酸根恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 碘化亚铁溶液与少量氯气反应:2I-+Cl2=I2+2Cl- |
4.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、HS- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、SCN-、SO42- |
14.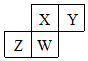 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
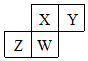 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
1.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 容量瓶 | C. | 蒸发皿 | D. | 圆底烧瓶 |
6.一定物质的量浓度的NaCl、MgCl2、AlCl3三种溶液与同体积同浓度的AgNO3完全反应,消耗三溶液的体积比为3:2:1,则三种溶液中Cl-的物质的量浓度之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:4 |