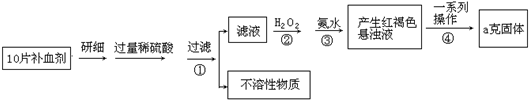
题目内容
在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是
- A.Fe2+
- B.Fe3+
- C.Al3+
- D.NH4+
C
试题分析:过氧化钠溶于水生成氢氧化钠和氧气,因此可以生成氢氧化铁沉淀、偏铝酸钠和氨气。由于过氧化钠还具有氧化性,可以把亚铁离子氧化生成铁离子,进而生成氢氧化铁沉淀,最后加入过量的盐酸,又分别生成氯化铁、氯化铝,所以离子数目几乎不变的是铝离子,其中铁离子增加,亚铁离子稀释,NH4+减少,答案选C。
考点:考查物质的性质及有关反应等
点评:本题容易错选A和B,这是由于忽略了过氧化钠的强氧化性导致的。
试题分析:过氧化钠溶于水生成氢氧化钠和氧气,因此可以生成氢氧化铁沉淀、偏铝酸钠和氨气。由于过氧化钠还具有氧化性,可以把亚铁离子氧化生成铁离子,进而生成氢氧化铁沉淀,最后加入过量的盐酸,又分别生成氯化铁、氯化铝,所以离子数目几乎不变的是铝离子,其中铁离子增加,亚铁离子稀释,NH4+减少,答案选C。
考点:考查物质的性质及有关反应等
点评:本题容易错选A和B,这是由于忽略了过氧化钠的强氧化性导致的。

练习册系列答案
相关题目
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
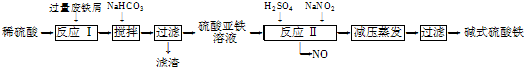
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 (填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 .
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 .若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 .
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)
聚合离子.该水解反应的离子方程式为 .
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO
.为检验所得产品中是否含有Fe2+,应使用的试剂为 (填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)
2+ 4 |
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO
- 3 |
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.