题目内容
下列反应中,离子方程式正确的是
| A.大理石溶于盐酸中:CO32-+2H+= CO2↑+H2O |
| B.AlCl3溶液中加入过量氨水:Al3++3NH3?H2O =Al(OH)3↓+ 3NH4+ |
| C.硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+ =BaSO4↓ |
| D.氯化铁溶液中加入铜片:Fe3++Cu = Fe2++Cu2+ |
B
解析试题分析:A、大理石的主要成分为CaCO3,离子方程式CaCO3+2H+=Ca2++CO2↑+H2O,故A正确;B、Al3+和氨水反应生成Al(OH)3沉淀和NH4+离子,故B正确;C、硫酸镁溶液与氢氧化钡溶液混合生成硫酸钡和氢氧化镁沉淀,离子方程式Mg2++2OH-+SO42-+Ba2+=BaSO4↓+Mg(OH)2↓;D、 铁离子和铜片反应生成亚铁离子和铜离子,离子方程式2Fe3++Cu=2Fe2++Cu2+。
考点:常见离子反应

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列离子方程式中正确的是
A.用Pt电极电解少量的CuCl2溶液:2H2O+Cu2++2Cl- H2↑+Cl2↑+Cu(OH)2↓ H2↑+Cl2↑+Cu(OH)2↓ |
| B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| C.酸性高锰酸钾溶液中滴加H2O2溶液4H2O2+ 4MnO4-+ 12H+ =" 4" Mn2+ + 10 H2O + 7O2↑ |
| D.向磁性氧化铁中加入氢碘酸:Fe3O4 +8H+=Fe2+ +2 Fe3+ +4H2O |
下列属于弱电解质的是
| A.H2SO4 | B.KOH | C.H2O | D.BaCl2 |
在碱性条件下,溶液无色且可以大量共存的离子组是
| A.K+、Ca2+、Cl-、HCO3- | B.Cu2+、Cl-、Na+、SO42- |
| C.Ba2+、Na+、Cl-、NO3- | D.Na+、Mg2+、NO3-、Cl- |
下列离子方程式中,正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+ SO42-+3S↓+2H2O SO42-+3S↓+2H2O |
B.向NaAlO2溶液中通入过量CO2:2AlO2- + CO2+ 3H2O  2Al(OH)3 + CO32- 2Al(OH)3 + CO32- |
C.FeS溶于过量稀硝酸中:FeS + 2H+ Fe2+ + H2↑ Fe2+ + H2↑ |
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+ I2+ 2H2O I2+ 2H2O |
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是: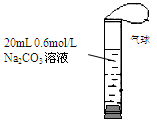
| A.有反应CO32- + 2H+ → CO2↑ + H2O发生 |
| B.有反应CO32- + H+ → HCO3-发生 |
| C.有反应CO32- + CO2 + H2O→ 2HCO3-发生 |
| D.加快盐酸注入速度不会改变反应现象 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
| B.甲基橙呈黄色的溶液:I-、Ba2+、AlO2-、Cl- |
| C.c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br- |
| D.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、Al3+ |
| B.pH=2的溶液中:Na+、ClO-、NH4+、SO42- |
| C.某透明澄清的溶液中:NH4+、Cu2+、NO3-、Cl- |
| D.0.1 mol·L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
下列反应的离子方程式正确的是
| A.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| B.实验室制二氧化碳:CaCO3 + 2H+= CO2↑ + H2O + Ca2+ |
| C.氯气与水反应:Cl2 + H2O = Cl-+ ClO-+ 2H+ |
| D.AlCl3溶液与过量氨水反应:Al3+ + 4NH3·H2O =AlO2-+ 4NH4+ + 2H2O |