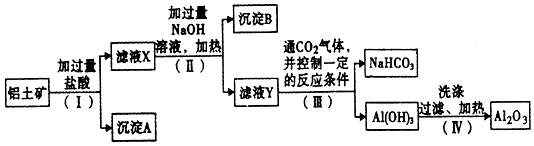
题目内容
5.现有100g过氧化氢溶液,测得其中含氢元素的质量分数为8%,加入8gCuSO4作催化剂制取氧气,充分反应后所得溶液(无晶体析出)中溶质的质量分数为( )| A. | 7.4% | B. | 10% | C. | 8% | D. | 11.1% |
分析 由于该反应会生成氧气和水,而氢元素最终会存在于反应后的水中,且质量不会变化,所以可依据化学式的有关计算求出反应后水的质量,即溶剂的质量,而溶质的质量即为硫酸铜的质量,据此分析解答.
解答 解:设反应后水的质量是xg.
由于双氧水分解过程中只放出氧气,故反应过程中H元素的质量守恒,故有:
xg×$\frac{2}{18}$=100g×8%
解得x=72g
待双氧水分解完全后,所得的溶液即为硫酸铜溶液,且由于硫酸铜做催化剂,故反应前后质量不变,故所得溶液的溶质质量分数=$\frac{8g}{8g+72g}$×100%=10%
故选B.
点评 此题是对元素质量守恒的考查,解题的关键是掌握有关反应的前后氢元素的质量不变,以此为突破口分析解答即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.据统计,金属腐蚀造成的损失远远超过火灾、水灾等自然灾害的总和,越来越被世界各国所重视,下面金属的防腐措施中,使用牺牲阳极的阴极保护法的是( )
| A. | 汽车底盘喷涂油漆 | B. | 掺防腐的金属制成不锈钢菜刀 | ||
| C. | 地下钢管连接锌块 | D. | 钢闸门连接电源负极 |
11.下列离子方程式正确的是( )
| A. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO2↑ | |
| D. | 将氯气通入KBr溶液中:Cl2+2Br-═2Cl-+Br2 |
8.下列说法不正确的是( )
| A. | 用元素分析仪来确定有机化合物的组成具有快速、微量、精确等特点 | |
| B. | 根据1H核磁共振谱图可以推知有机物分子中有几种不同类型的氢原子 | |
| C. | 用铜丝燃烧法可定性确定有机物中是否存在卤素 | |
| D. | 通过红外光谱可以测知有机物的相对分子质量 |
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCL溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且 c (Cl-)>0.4mol/L | |
| C. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| D. | CO32-、Al3+-定不存在,K+可能存在 |
17.下列说法正确的是( )
| A. | 化合物 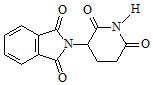 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | CH3(CH2)2CH3与CH(CH3)3具有不同数目的一氯代物 | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |