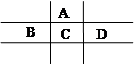题目内容
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的基态电子排布式为
__________________________________________________________________________;
(3)在X、Y、Z三种元素中,第一电离能由大到小的顺序是______________________;
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为___________________________________________。
(10分) (1)+2价; O2->Na+或Na+<O2- (2) 1S22S22P63S23P4
(3)F> N > O (4)HN3+OH-=N+H2O
解析试题分析:根据元素在周期表中的位置可知,X是氮元素,Y是氧元素,Z是F元素,R是S元素,W是Br元素,J是Xe元素。
(1) F元素的非金属性强于氧元素,则在化合物YZ2中Y的化合价为+2价。Y2-与Na+的核外电子排布相同,则微粒半径随原子序数的增大而减小,即微粒半径大小为O2->Na+或Na+<O2-。
(2)S原子的原子序数是16,则根据工作原理可知,S原子的基态电子排布式为1S22S22P63S23P4。
(3)非金属性越强,第一电离能越大。由于氮元素的2p轨道电子处于半充满状态,所以氮元素的第一电离能大于氧元素的,则在X、Y、Z三种元素中,第一电离能由大到小的顺序是F>N>O。
(4)醋酸是一元弱酸,则如果酸HX3的酸性与醋酸相近,那么HX3溶液与NaOH溶液反应的离子方程式为HN3+OH-=N+H2O。
考点:考查元素推断、核外电子排布式、微粒半径比较、化合价以及第一电离能的大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
(1)画出元素②的原子结构示意图 。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可
看到大量的白烟,写出产生该现象的化学方程式: 。
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。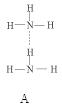
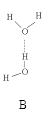
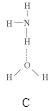
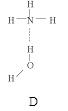
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来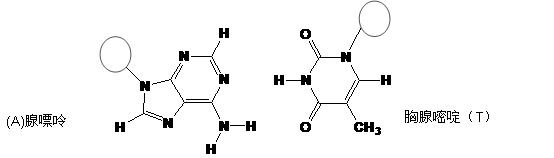

(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。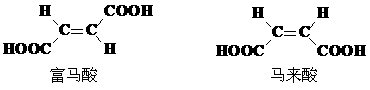
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |
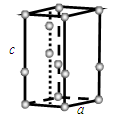
回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
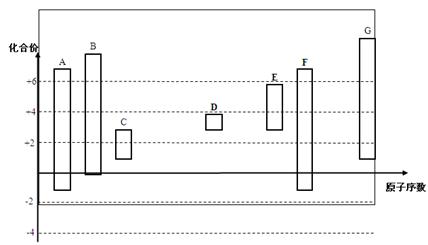
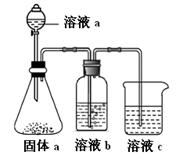

 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。