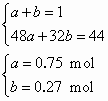题目内容
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3![]() NaNO3+NaNO2+CO2 ①
NaNO3+NaNO2+CO2 ①
NO+NO2+Na2CO3![]() 2NaNO2+CO2 ②
2NaNO2+CO2 ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2,吸收液质量将增加多少克?
(2)配制1000 g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000 g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况)CO2时,吸收液质量就增加44 g.
①计算吸收液中NaNO2和NaNO3物质的量之比.
②1000 g质量分数为21.2%的纯碱在20 ℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2 g/100 g水)
答案:
解析:
解析:
|
解答:(1)48 (2)m(Na2CO3·10H2O)=572 g (3)①2NO2+NaCO3 NO+NO2+Na2CO3 设由NO2与纯碱反应产生的CO2为a mol,由NO和NO2与纯碱反应产生的CO2为b mol. n(NaNO2)∶n(NaNO3)=5∶3 ②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol. 据Na+守恒:5x+3x=8x=0.5 m(NaNO2)=172.5 g,m(H2O)余=1000 g×7.88%-688 g=100 g 析出:m(NaNO2)最大=172.5 g-71.2 g=101.3 g |

练习册系列答案
相关题目