题目内容
现有含Cl-的固体试样,其Cl-的质量分数为A%,为了确定试样是否合格,并简化计算过程,实验者用0.200mol/L的AgNO3标准液滴定已称量的试样配制的溶液,让滴入的AgNO3溶液的mL数正好等于样品中Cl-的质量分数的A值,求称取试样质量为多少?
分析:发生反应Ag++Cl-=AgCl↓,可知n(AgNO3)=n(Cl-),取AgNO3标准液的体积为A mL,根据n=cV计算n(AgNO3),进而计算m(Cl-),试样质量=
.
| Cl-的质量 |
| Cl-的质量分数 |
解答:解:取AgNO3标准液的体积为A mL,则n(AgNO3)=A×10-3L×0.2mol/L=2A×10-4mol,
发生反应Ag++Cl-=AgCl↓,可知n(Cl-)=n(AgNO3)=2A×10-4mol,
故m(Cl-)=2A×10-4mol×35.5g/mol=n(Cl-)=71A×10-4g,试样质量=
=0.71g
答:称取试样质量为0.71g.
发生反应Ag++Cl-=AgCl↓,可知n(Cl-)=n(AgNO3)=2A×10-4mol,
故m(Cl-)=2A×10-4mol×35.5g/mol=n(Cl-)=71A×10-4g,试样质量=
| 71A×10-4g |
| A% |
答:称取试样质量为0.71g.
点评:本题考查离子方程式的计算,难度不大,注意基础知识的理解掌握,注意对题目信息的提取利用.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
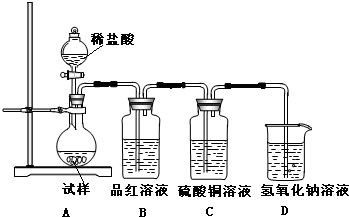 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是