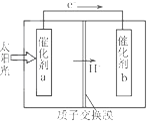
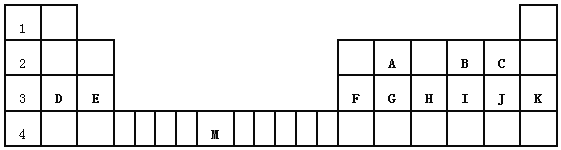
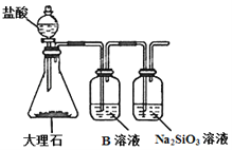
��Ŀ����
����Ŀ������˵����ȷ����
A. ˮ�����ӻ�����KWֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B. Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C. �����£���0.10 mol��L��1��NH3��H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c(NH4+)/c(NH3��H2O)��ֵ����
D. �����£�CH3COOH��Ka��1.7��10��5��NH3��H2O��Kb��1.7��10��5��CH3COOH��Һ�е�c(H��)��NH3��H2O�е�c(OH��)���
���𰸡�C
��������
A��ˮ�����ӻ����¶��йأ�����ǿ��ǿ����(��NaCl)��Ӱ��ˮ�ĵ��룬��A����B���ܶȻ��������¶ȵĺ�����ֻ���¶ȵ�Ӱ�죬����Һ������Ũ�ȴ�С�أ���B����C������NH4Cl��NH3H2ONH4++OH-ƽ�����淴Ӧ�����ƶ�������������Ũ�ȼ�С����Һ��pH��С�����ݵ���ƽ�ⳣ����֪c(NH4+)/c(NH3H2O)=![]() ��ֵ����C��ȷ��D��ֻ֪��ƽ�ⳣ������֪��Һ��Ũ�ȣ���������Һ��c(H+)��c(OH-)����D����ѡC��
��ֵ����C��ȷ��D��ֻ֪��ƽ�ⳣ������֪��Һ��Ũ�ȣ���������Һ��c(H+)��c(OH-)����D����ѡC��

��ϰ��ϵ�д�
 С�����ϵ�д�
С�����ϵ�д�
�����Ŀ