题目内容
下列有关说法正确的是
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.生铁中含有碳,抗腐蚀能力比纯铁强 |
| D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料 |
D
解析试题分析:A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,而△S>0,说明该反应的△H>0;B.镀锌铁制品镀层受损后,形成原电池,锌做负极,铁被保护,不易生锈,B错误;C.生铁中含有碳,易形成原电池铁被腐蚀,抗腐蚀能力不如纯铁强;C错误;D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料,正确。
考点:原电池和化学反应方向。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)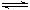 N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是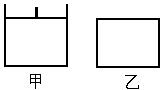
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
在固定体积容器中通入2mol A与1mol B气体,一定条件下发生反应:2A(g)+B(g)  3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( ) 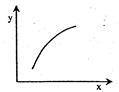
| 选项 | x | y |
| A | 降温 | A的体积分数 |
| B | 升高温度 | 混合气体的密度 |
| C | 再加入A | B的转化率 |
| D | 再加入C | A的体积分数 |
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应X(g)+ Y(g) 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表( )
| t / min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数减小了 | D.a>b |
氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
| A.5.4×10—5 | B.4.5×10—4 | C.0.015 | D.无法计算 |
在密闭容器中进行下列反应M(g)+N(g)  R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )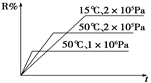
| A.正反应放热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应吸热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
实验室用足量铁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2 SO4粉末 | D.K2 SO4固体 |
已知某可逆反应在密闭容器中进行:A(g)+2B(g)  3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )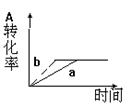
| A.增大A的浓度 | B.增大容器的体积 |
| C.加入催化剂 | D.升高温度 |