题目内容
现有几种物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
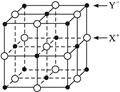
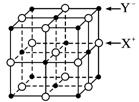
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。
(1)原子 共价键
(2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多
(4)②④
(5)2NAa3ρ
12.如何比较分子晶体和原子晶体的熔沸点?
解析:
(1)一般地,原子晶体的熔沸点远远高于分子晶体的熔沸点。
(2)同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大熔沸点越高。
原子晶体熔沸点的高低与共价键的强弱有关。一般来说,原子半径越小,形成的共价键的键长越短,键能越大,晶体的熔沸点越高。如熔点:金刚石>碳化硅>晶体硅。
分子晶体的熔沸点高低与分子间作用力有关。组成和结构相似的物质,相对分子质量越大,熔沸点越高,如熔沸点:O2>N2,HI>HBr>HCl。如果分子间存在氢键,则其沸点要高于组成和结构相似的没有氢键的分子晶体,如沸点:H2O>H2S,HF>HCl,NH3>PH3。组成和结构不相似的物质,分子的极性越大,其熔沸点就越高,如熔沸点:CO>N2。

A组 | B组 | C组 | D组 |
金刚石:3 | Li: | HF: | NaCl: |
硅晶体:1 | Na: | HCl: | KCl: |
硼晶体:2 | K: | HBr: | RbCl: |
二氧化硅1 | Rb: | HI: | CsCl: |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为NA mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。

A组 | B组 | C组 | D组 |
金刚石:3550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
硅晶体:1410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
硼晶体:2300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
二氧化硅1723 ℃ | Rb:39 ℃ | Hi:-51 ℃ | CsCl:645 ℃ |
据此完成下列问题:
(1)A组属于__________晶体,其熔化时克服的粒子间的作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性?
(3)C组中HF熔点反常是由于____________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为NA mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为__________g·mol-1。