题目内容
【题目】(1)H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________________。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)___(填“增大”“减小”或“不变”),原因是______。
(3)含有![]() 的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含4.00×10-3 mol·L-1的Cr2O![]() 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:![]()
![]() Cr2+、Fe3+
Cr2+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______。
②若处理后的废水中残留的c(Fe3+)=1×10-13 mol·L-1,则残留的Cr3+的浓度为__________________。{已知:Ksp[Fe(OH)3]≈1.0×10-38 ,Ksp[Cr(OH)3]≈1.0×10-31}
【答案】c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)减小加少量Na2A固体,A2-浓度增大,CaA的溶解平衡向左移动,所以c(Ca2+)减小Cr2O![]() +14H++6Fe2+===2Cr3++6Fe3++7H2O1×10-6 mol·L-1
+14H++6Fe2+===2Cr3++6Fe3++7H2O1×10-6 mol·L-1
【解析】
(1) H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-,所以H2A 是二元弱酸,NaHA在溶液中存在电离平衡和水解平衡,溶液显酸性,说明HA-的电离程度大于水解程度,以此分析。
H++A2-,所以H2A 是二元弱酸,NaHA在溶液中存在电离平衡和水解平衡,溶液显酸性,说明HA-的电离程度大于水解程度,以此分析。
(2)加少量Na2A固体,A2-浓度增大,CaA的溶解平衡向左移动。
(3) ①亚铁离子被氧化的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
②根据Ksp[Fe(OH)3]=1.0×10-38 和Ksp[Cr(OH)3]≈1.0×10-31 可知![]() =
=![]() ,根据c(Fe3+)浓度可求出Cr3+的浓度。
,根据c(Fe3+)浓度可求出Cr3+的浓度。
(1)因为钠离子不水解,HA-既水解又电离,所以c(Na+)>c(HA-),因为NaHA溶液显酸性,所以HA-的电离大于水解,又因为水电离也能产生H+,所以c(H+)>c(A2-),水的电离很微弱,OH-浓度很小,所以c(A2-)>c(OH-),综上,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
因此,本题正确答案是:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
(2)由于加入Na2A固体,c(A2-)增大,从而导致溶解平衡左移,c(Ca2+)减小。
因此,本题正确答案是:减小;加少量Na2A固体,A2-浓度增大,CaA的溶解平衡向左移动,所以c(Ca2+)减小。
(3)Cr2O![]() 有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O
有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O![]() 在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O
在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O![]() +14H++6Fe2+===2Cr3++6Fe3++7H2O;
+14H++6Fe2+===2Cr3++6Fe3++7H2O;
因此,本题正确答案是:Cr2O![]() +14H++6Fe2+===2Cr3++6Fe3++7H2O。
+14H++6Fe2+===2Cr3++6Fe3++7H2O。
(4)根据Ksp[Fe(OH)3]=1.0×10-38 和Ksp[Cr(OH)3]≈1.0×10-31,若处理后的废水中残留的c(Fe3+)=1×10-13molL-1,![]() =
=![]() ,c(Cr3+)=
,c(Cr3+)=![]() mol/L=1×10-6molL-1。
mol/L=1×10-6molL-1。
因此,本题正确答案是:1×10-6 mol·L-1。

 智慧小复习系列答案
智慧小复习系列答案【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
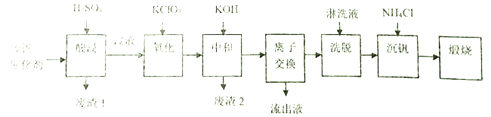
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
(1) 已知:2NO(g)+O2(g)===2NO2(g) ΔH1
NO(g)+O3(g)===NO2(g)+O2(g) ΔH2
2NO2(g)![]() N2O4(g) ΔH3
N2O4(g) ΔH3
2N2O5(g)===4NO2(g)+O2(g) ΔH4
则反应N2O4(g)+O3(g)===N2O5(g)+O2(g)的ΔH=__________。
(2)从N2O5在一定条件下发生分解:2N2O5(g)===4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(3)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测N2O4(g)![]() 2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。
2NO2(g)是吸热反应还是放热反应,说明理由_______________,若要提高N2O4转化率,除改变反应温度外,其他措施有____________(要求写出两条)。