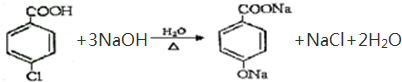
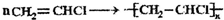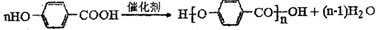题目内容
2.3 g某含氧有机物A完全燃烧后,生成4.4 g CO2和2.7 g H2O,测得该化合物的相对分子量为46,求该有机物的分子式.
答案:
解析:
解析:
|
答案:C2H6O 思路解析:本题考查根据有机物燃烧生成的产物的量的关系来确定有机物分子式的推断计算能力. (1)2.3 g某含氧有机物A 4.4 g CO2含C物质的量: 4.4 g÷44 g·mol-1=0.1 mol 2.7 g H2O含H物质的量: 2.7 g÷18 g·mol-1×2=0.3 mol 2.3 g有机物A含氧: m(O)=m(A)-m(C)-m(H) =2.3 g-0.1 mol×12 g·mol-1-0.3 mol×1 g·mol-1=0.8 g n(O)=0.8 g÷16 g·mol-1=0.05 mol (2) 2.3 g该含氧有机物A的物质的量: 2.3 g÷46 g·mol-1=0.05 mol (3)有机物 - C - H - O 0.05 mol 0.1 mol 0.3 mol 0.05 mol 所以该有机物的分子式为C2H6O. 绿色通道:确定有机物的分子式方法之一是物质的量关系法,分三步:(1)求组成元素原子的物质的量.(2)求给定物质的物质的量.(3)确定分子式(根据倍数关系). 有机物完全燃烧后,由生成的二氧化碳和水的量的关系,可以确定原来的有机物中碳原子和氢原子的个数关系,甚至是物质的量等关系,再利用质量守恒定律,来判断含氧原子的量,进而确定有机物的分子组成. |

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
 .
.