题目内容
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp="x" ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
(14分)(每空2分)(1)N≡N 
(2)2Mg+CO2 2MgO+C
2MgO+C
(3)3SO2+3Ba2++2 H2O +2NO3-=3BaSO4↓+2NO↑+4 H+ SO2
(4)NH4H SO4 100x
解析试题分析:A元素的一种核素中不含中子,则A是H元素;使品红溶液褪色的化合物应是SO2,所以F是S元素,D是O元素;B比D的原子序数小,且B的单质在D2中燃烧可生成BD和BD2两种气体,则B是C元素;则C是N元素,E是Mg元素。
(1)氮气分子中存在氮氮三键,所以其结构式为N≡N ;MgO是离子化合物,所以其电子式为
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,黑色固体为单质C,白色固体为MgO,所以化学方程式为2Mg+CO2 2MgO+C
2MgO+C
(3)SO2气体通入BaCl2和HNO3的混合溶液中,被硝酸氧化成硫酸根离子,与钡离子结合生成硫酸钡沉淀,离子方程式为3SO2+3Ba2++2 H2O +2NO3-=3BaSO4↓+2NO↑+4 H+;在该反应中硝酸作氧化剂,NO是还原产物,SO2作还原剂,所以SO2的还原性大于NO的还原性;
(4)H、N、O、S四种元素构成的化合物一般为铵盐,所以按原子个数比为5 :1 :4 :1形成化合物甲的化学式为NH4H SO4;Ba2+的物质的量是SO42-的物质的量的3倍,所以二者结合成BaSO4后,溶液中有Ba2+剩余,其物质的量浓度是(0.03mol/L-0.01mol/L)/2=0.01mol/L,根据该沉淀的Ksp=c(Ba2+)c(SO42-)="x" ,所以则混合溶液中酸根离子的浓度c(SO42-)="x/" c(Ba2+)=100x。
考点:考查元素推断,结构式、电子式、化学方程式、离子方程式的书写,还原性强弱的判断,Ksp的有关计算

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
(8分)(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素(3)元素在元素周期表中的位置与元素原子结构的关系_______________________ 。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
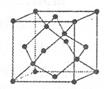
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
| A.SiO2和干冰的熔化 | B.氧化钠和钠的熔化 |
| C.晶体硅和晶体硫的熔化 | D.碘和干冰的气化 |