��Ŀ����
NH3����Ҫ�Ļ���ԭ�ϡ�ijʵ���Ҷ������������о���
��1����ͬ�¶��£������������Ϊ2.0L�ĺ����ܱ������з�����Ӧ��N2(g)��3H2(g)  2NH3(g)����Ӧ�����вⶨ�IJ������ݼ��±���
2NH3(g)����Ӧ�����вⶨ�IJ������ݼ��±���
������� | ��ʼ�����ʵ����ʵ���/mol | ƽ�����ʵ���(mol) | ƽ��ѹǿ(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
�� | 4 | 12 | 0 | 4 | P1 |
�� | 2 | 6 | 0 | C2 | P2 |
�� | 1.5 | 4.0 | 3 | ? | ? |
�����������з�Ӧ50�뵽��ƽ�⣬���ʱ��v(H2)= mol/(L��s)
���������з�Ӧ������ƽ��ʱc2 2;p1 2p2(�>������<����=��)
���������У��ﵽƽ��ǰv(��) v(��) (�>������<����=��)
��2������֪��N2(g)+3H2(g) 2NH3(g) ��H=-92.4kJ/mol
2NH3(g) ��H=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) ��H=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=-483.6 kJ/mol
��4NH3(g)+5O2(g) 4NO(g)+6H2O(g)����H= KJ/mol
4NO(g)+6H2O(g)����H= KJ/mol
�ڽ�4molNH3��5molO2�ֱ�����5�������ͬ���¶Ȳ�ͬ���������ڲ�ϵ���������½��з�Ӧ����ͬʱ������5��������NO������ͼ��ʾ������˵����ȷ���� (����ĸ)��

A��a��v(��)����v(��)
B��c�㷴Ӧ�������
C���¶ȸ���900��ʱ��NO�����½���ԭ������Ϊ�¶����ߵ���ƽ�������ƶ�
��3������һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϡ���ص��ܷ�ӦΪ��4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)�����ȼ�ϵ�صĸ�����Ӧʽ�� ��
 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�


 2CO2(g)+N2(g)����֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ����
2CO2(g)+N2(g)����֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊ1��1059������˵����ȷ����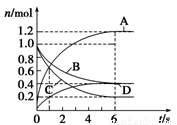
 6A��2C
6A��2C