题目内容
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液。则下列说法不正确的是 ( )
| A.试管塞越来越紧,是因为反应消耗了大量O2 |
| B.打开试管塞前Cu元素的化合价为+1价 |
C.溶液迅速变为蓝色溶液,是因为反应生成了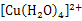 |
| D.上述反应原理可用于测定O2的含量 |
C
解析试题分析:振荡后试管越来越紧,属于减压状态,说明试管中的O2参与了反应。化学反应为:4Cu+8NH3+O2+2H2O→4[Cu(NH3)2]OH;打开试管塞后,溶液迅速变为蓝色溶液说明+1价的铜被氧化成+2价,[Cu(NH3)2]OH→[Cu(NH3)4](OH)2。根据铜粉质量可以测定试管中O2的含量。故C选项错误。
考点:考查铜粉与浓氨水反应的化学原理及实验现象的知识。

练习册系列答案
相关题目
关于化学键的各种叙述正确的是
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.只有共价键形成的物质,不一定是共价化合物 |
| C.非极性键只存在于双原子的单质分子中 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物Al2H6的球棍模型如下图所示,它的熔点为150℃,燃烧热极高。下列说法肯定错误的是
| A.Al2H6在固态时所形成的晶体是分子晶体 |
| B.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| D.氢铝化合物中可能存在组成为的物质(n为正整数) |
下列说法正确的是
| A.键能越大,表示该分子越容易受热分解 |
| B.共价键都具有方向性 |
| C.在分子中,两个成键的原子间的距离叫键长 |
| D.H—Cl的键能为431.8kJ·mol-1,H—Br的键能为366kJ·mol-1,说明HCl比HBr分子稳定 |
下列物质中,既含有离子键又含有非极性键的是
| A.Na2O2 | B.CO2 | C.苯 | D.NH4Cl |
下列物质中,含有非极性共价键的是
| A.H2 | B.H2O | C.NaCl | D.NaOH |
下列变化需克服相同类型作用力的是
| A.碘和干冰的升华 | B.硅和C60的熔化 | C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
已知:N2+O2 2NO △H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
2NO △H=+180 kJ/mol,其中N≡N,O=O键的键能分别是946 kJ/mol、498 kJ/mol,则NO中化学键的键能为
| A.812 kJ/mol | B.632 kJ/mol | C.1264 kJ/mol | D.1624 kJ/mol |
某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
| A.X原子可能为第ⅤA族元素 |
| B.Y原子一定为第ⅠA族元素 |
| C.该分子中,既含极性键,又含非极性键 |
| D.从圆球的大小分析,该分子可能为N2F4 |