题目内容
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
【答案】D
【解析】
A.将反应后的溶液分成2等份,一份溶液中滴加![]() 溶液,无明显现象,则不含
溶液,无明显现象,则不含![]() ,所以溶液为
,所以溶液为![]() 、
、![]() 、
、![]() 的混合液。在另一份溶液中滴加氨水至过量,得到沉淀
的混合液。在另一份溶液中滴加氨水至过量,得到沉淀![]() 为
为![]() 和
和![]() ,
,![]() 则转变为
则转变为![]() ,过滤后进入滤液。固体
,过滤后进入滤液。固体![]() 为
为![]() 和
和![]() ,不溶物
,不溶物![]() 为
为![]() ,合金加入到硝酸溶液后,放出无色气体
,合金加入到硝酸溶液后,放出无色气体![]() 标准状况下
标准状况下![]() 即
即![]() ,根据得失电子守恒,合金总共失去电子
,根据得失电子守恒,合金总共失去电子![]() ,反应后溶液中阳离子带正电荷
,反应后溶液中阳离子带正电荷![]() ,所以溶液中硝酸根
,所以溶液中硝酸根![]() ,所以
,所以![]() ,A正确;
,A正确;
B.根据电子守恒可知:![]() ,合金总质量为:
,合金总质量为:![]() ,固体减少的
,固体减少的![]() 为氢氧化铝、氢氧化铁分解生成的水,则
为氢氧化铝、氢氧化铁分解生成的水,则![]() ,固体
,固体![]() 和
和![]() 中H元素的物质的量之和等于:
中H元素的物质的量之和等于:![]() ,可得
,可得![]() ,原固体中
,原固体中![]() ,
,![]() ,则
,则![]() ,所以
,所以![]() ,B正确;
,B正确;
C.由于溶液中不含![]() ,为
,为![]() 、
、![]() 、
、![]() 的混合液,所以硝酸足量,若将上述nmol稀硝酸逐滴加入到合金中,先生成
的混合液,所以硝酸足量,若将上述nmol稀硝酸逐滴加入到合金中,先生成![]() ,后
,后![]() 继续被硝酸氧化,由于硝酸足量,最终生成
继续被硝酸氧化,由于硝酸足量,最终生成![]() 、
、![]() 、
、![]() ,根据得失电子守恒生成的NO气体仍为
,根据得失电子守恒生成的NO气体仍为![]() ,C正确;
,C正确;
D.最后剩余不溶物dg,为![]() ,是一确定值,D错误。
,是一确定值,D错误。
故选D。

【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
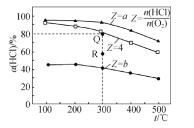
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
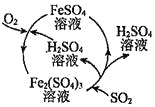
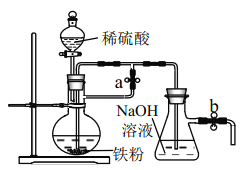
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
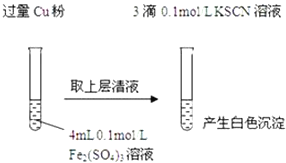
(1)Fe3+与Cu粉发生反应的离子方程式为______.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.