题目内容
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )分析:A、先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质.
C、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质,从而确定发生的离子反应.
D、先确定B溶液中的溶质,再根据碳酸氢钠和盐酸的反应方程式计算生成二氧化碳的体积.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质.
C、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质,从而确定发生的离子反应.
D、先确定B溶液中的溶质,再根据碳酸氢钠和盐酸的反应方程式计算生成二氧化碳的体积.
解答:解:A、先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为Cmol/L,0.01L×Cmol/L=0.1mol/L×0.075L,C=0.75,故A错误.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积远远大于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是氢氧化钠和碳酸钠,故B错误.
C、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积小于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是碳酸钠和碳酸氢钠,所以B
线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:H++CO32-=HCO3-,故C错误.
D、通过C知,B溶液中的溶质是碳酸钠和碳酸氢钠,碳酸钠和盐酸反应生成碳酸氢钠,有气体生成的化学反应方程式为:
HCO3-+H+=H2O+CO2↑,所以当盐酸的为25mL时有二氧化碳生成,即发生的化学反应为:HCO3-+H+=H2O+CO2↑,设生成气体的体积为V.
HCO3-+H+=H2O+CO2↑
1mol 22.4L
0.1(0.075-0.025)mol V
V=
=0.112L=112mL,故D正确.
故选D.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积远远大于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是氢氧化钠和碳酸钠,故B错误.
C、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积小于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是碳酸钠和碳酸氢钠,所以B
线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:H++CO32-=HCO3-,故C错误.
D、通过C知,B溶液中的溶质是碳酸钠和碳酸氢钠,碳酸钠和盐酸反应生成碳酸氢钠,有气体生成的化学反应方程式为:
HCO3-+H+=H2O+CO2↑,所以当盐酸的为25mL时有二氧化碳生成,即发生的化学反应为:HCO3-+H+=H2O+CO2↑,设生成气体的体积为V.
HCO3-+H+=H2O+CO2↑
1mol 22.4L
0.1(0.075-0.025)mol V
V=
| 22.4L×0.1(0.075-0.025)mol |
| 1mol |
故选D.
点评:本题考查混合物的计算,题目难度较大,本题关键是根据图象判断溶液溶质的成分,结合离子方程式利用守恒定律计算.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
在理解概念的基础上,理清概念之间的相互关系,构建知识网络是学习化学的重要方法,如图是中学化学常见化学概念之间的相互关系.
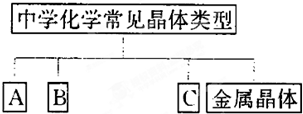
(1)完成下表,且实例按以下要求填写.
①只能由 H、O、N、Si、S元素中的一种或几种组成物质;②每种元素只能出现一次,化合物中最多含一种原子团;③所填物质必须能够回答问题(2)和问题(3).
(2)取上述表格中A、B、C三种晶体中某一晶体溶于水得W溶液,写出等物质的量浓度等体积的硫酸氢钠与W溶液反应的离子方程式 ;
(3)写出上述表格中熔点最高的物质与氢氧化钠反应的化学方程式: .

(1)完成下表,且实例按以下要求填写.
①只能由 H、O、N、Si、S元素中的一种或几种组成物质;②每种元素只能出现一次,化合物中最多含一种原子团;③所填物质必须能够回答问题(2)和问题(3).
| A | B | C | ||
| 晶体类别 | 金属晶体 | |||
| 实例的化学式 | Na |
(3)写出上述表格中熔点最高的物质与氢氧化钠反应的化学方程式:
在理解概念的基础上,理清概念之间的相互关系,构建知识网络是学习化学的重要方法,下图是中学化学常见化学概念之间的相互关系。
 |
(1) 完成下表,且实例按以下要求填写。
①只能由H、O、N、Si、S元素中的一种或几种组成物质;②每种元素只能出现一次,化合物中最多含一种原子团;③所填物质必须能够回答问题(2)和问题(3)。
A | B | C | ||
晶体类别 | 金属晶体 | |||
实例的化学式 | Na |
(2)取上述表格中A、B、C三种晶体中某一晶体溶于水得W溶液,写出等物质的量浓度等体积的硫酸氢钠与W溶液反应的离子方程式 ;
(3)写出上述表格中熔点最高的具体物质与氢氧化钠反应的化学方程式 。
![]()
