题目内容
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示. 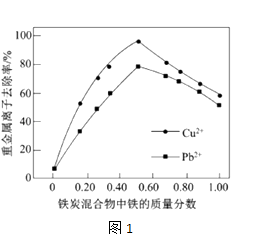
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物. ①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为4Fe+NO3﹣+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 . 
【答案】
(1)Cr2O72﹣+14H++6e﹣=2Cr3++7H2O
(2)活性炭对Cu2+和Pb2+有吸附作用;铁的质量分数增加,铁炭混合物中微电池数目减少
(3)2Fe2++BH4﹣+4OH﹣=2Fe+B(OH)4﹣+2H2↑;纳米铁粉与H+反应生成H2;Cu或Cu2+催化纳米铁粉去除NO3﹣的反应(或形成的Fe﹣Cu原电池增大纳米铁粉去除NO3﹣的反应速率)
【解析】解:(1)正极上Cr2O72﹣转化为Cr3+ , 发生还原反应,在酸性溶液中,电极方程式为Cr2O72﹣+14H++6e﹣=2Cr3++7H2O,所以答案是:Cr2O72﹣+14H++6e﹣=2Cr3++7H2O;(2)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,可去除水中少量的Cu2+和Pb2+ , 原因是碳粉具有吸附性,也可起到净水的作用,所以答案是:活性炭对Cu2+和Pb2+具有吸附作用;②随着铁的质量分数的增加,形成的微电池数目减少,反应速率减小,则Cu2+和Pb2+的去除率不升反降,所以答案是:铁的质量分数增加,铁炭混合物中微电池数目减少;(3)①向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4﹣+4OH﹣=2Fe+2H2↑+B(OH)4﹣ , 所以答案是:2Fe2++BH4﹣+4OH﹣=2Fe+2H2↑+B(OH)4﹣;②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气,可导致NO3﹣的去除率下降,所以答案是:纳米铁粉与H+反应生成H2;③由图2可知铜离子浓度越大,去除率越大,铜离子可起到催化作用,也可能形成原电池反应,所以答案是:Cu或Cu2+催化纳米铁粉去除NO3﹣的反应(或形成Fe﹣Cu原电池增大纳米铁粉去除NO3﹣的反应速率).

【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题.已知:CO (g)+H2O (g)H2 (g)+CO2 (g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= , △H=0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s)+CO2 (g)2CO (g)平衡常数K1;
C (s)+H2O(g)CO(g)+H2 (g)平衡常数K2则K、K1、K2 , 之间的关系是;
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为:若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40molCO2 , 此时v正v逆 (填“>”、“=”或“<”).
【题目】某原电池的总反应是Zn+Cu2+=Zn2++Cu,则该原电池的组成正确的是( )
A | B | C | D | |
正极 | Zn | Zn | 碳棒 | Cu |
负极 | 碳棒 | Fe | Zn | Zn |
电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
A. AB. BC. CD. D
