题目内容
【题目】我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
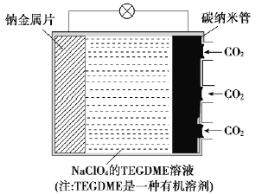
(1)钠金属片作为该电池的___极(填“正”或“负”,下同);放电时,电解质溶液中Na+从___极区向___极区移动。
(2)充电时,碳纳米管连接直流电源的___极,电极反应式为___。
【答案】负 负 正 正 2Na2CO3+C-4e-=3CO2↑+4Na+
【解析】
(1)从电池总反应4Na+3CO2![]() 2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中阳离子向正极区移动。
2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中阳离子向正极区移动。
(2)充电时,负极连接直流电源的负极,正极连接直流电源的正极,电极反应式为作原电池正极时反应的逆反应。
(1)从电池总反应4Na+3CO2![]() 2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中Na+(阳离子)从负极区向正极区移动。答案为:负;负;正;
2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中Na+(阳离子)从负极区向正极区移动。答案为:负;负;正;
(2)充电时,负极(钠金属片)连接直流电源的负极,碳纳米管(正极)连接直流电源的正极,电极反应式为2Na2CO3+C-4e-=3CO2↑+4Na+。答案为:正;2Na2CO3+C-4e-=3CO2↑+4Na+。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)