题目内容
【题目】某实验小组的同学在实验室利用下列装置进行实验。
请回答下列问题:
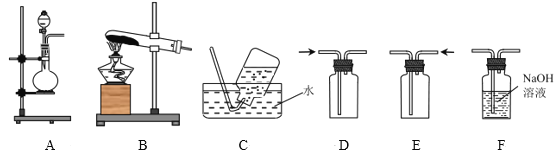
(1)甲同学用A装置制备NO2气体,上述装置中可用于收集NO2气体的是___(填字母),A中发生反应的离子方程式为___。
(2)乙同学用图中的装置A进行铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是___,该反应的化学方程式为___;实验所产生的SO2尾气选用装置___(填字母)来吸收。
(3)丙同学用装置B制取氨气,发生反应的化学方程式是___;为了检验集气瓶中氨气是否集满,可将湿润的红色石蕊试纸置于导管口,若___,则证明已收集满;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是___,该反应的化学方程式为___。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2LNO时,被氧化的物质的质量是___g。
【答案】D Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O 酒精灯 Cu+2H2SO4(浓)
=Cu2++2NO2↑+2H2O 酒精灯 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ F 2NH4Cl+Ca(OH)2
CuSO4+2H2O+SO2↑ F 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 红色石蕊试纸变蓝 产生白烟 NH3+HCl=NH4Cl 8.5
CaCl2+2NH3↑+2H2O 红色石蕊试纸变蓝 产生白烟 NH3+HCl=NH4Cl 8.5
【解析】
实验室采用铜与浓硝酸反应制备二氧化氮,二氧化氮的密度比空气大,故用向上排空气法收集;实验室可采用浓硫酸与铜在加热条件下反应制备二氧化硫;实验室采用加热氢氧化钙与氯化铵固体的方法制备氨气。
(1)甲同学用A装置可采用铜与浓硝酸反应制备NO2气体,则A中发生反应的离子方程式为Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O;二氧化氮的密度比空气大,故用向上排空气法收集,故上述装置中可用于收集NO2气体的是D。
=Cu2++2NO2↑+2H2O;二氧化氮的密度比空气大,故用向上排空气法收集,故上述装置中可用于收集NO2气体的是D。
(2)铜与浓硫酸要在加热条件下反应,故用装置A进行铜与浓硫酸反应制取SO2气体时,装置A中还缺少的仪器名称是酒精灯,该反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;二氧化硫有毒,为酸性氧化物,能与氢氧化钠反应,故实验所产生的SO2尾气选用装置F来吸收。
CuSO4+2H2O+SO2↑;二氧化硫有毒,为酸性氧化物,能与氢氧化钠反应,故实验所产生的SO2尾气选用装置F来吸收。
(3)丙同学采用固固加热制备气体的装置,可加热氢氧化钙与氯化铵固体的方法制备氨气,发生反应的化学方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;为了检验集气瓶中氨气是否集满,可将湿润的红色石蕊试纸置于导管口,氨气溶于水显碱性,故若红色石蕊试纸变蓝,则证明已收集满;氨气与氯化氢气体反应产生白烟,反应方程式为NH3+HCl=NH4Cl,故若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟。
CaCl2+2NH3↑+2H2O;为了检验集气瓶中氨气是否集满,可将湿润的红色石蕊试纸置于导管口,氨气溶于水显碱性,故若红色石蕊试纸变蓝,则证明已收集满;氨气与氯化氢气体反应产生白烟,反应方程式为NH3+HCl=NH4Cl,故若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟。
(4)丙同学在实验室中模拟氨的催化氧化反应,即4NH3+5O2![]() 4NO+6H2O,氮元素由-3价变为+2价,故NH3被氧化,当生成标准状况下11.2LNO即0.5molNO时,被氧化的NH3质量是0.5mol×17g/mol=8.5g。
4NO+6H2O,氮元素由-3价变为+2价,故NH3被氧化,当生成标准状况下11.2LNO即0.5molNO时,被氧化的NH3质量是0.5mol×17g/mol=8.5g。

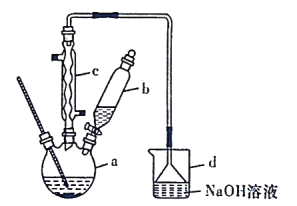
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g/cm3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在装置a中加入15mL无水苯和少量铁屑。在装置b中小心加入4.0mL液态溴。向装置a中滴入几滴溴,有白雾产生。继续滴加至液溴滴完。装置d的作用是吸收________和少量溴蒸汽。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是________________________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填字母代号)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母代号)。
A.25mL B.50mL
C.250mL D.500mL