题目内容
1.四种短周期元素的离子aXm+、bYn+、cZn-、dRm-,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm->Zn-
⑥X一定可与冷水反应.
| A. | 只有②正确 | B. | ①②③④正确 | C. | ①②③⑥正确 | D. | ②③⑤正确 |
分析 四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数大小顺序是:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,即X、Y处于第三周期,Z、R处于第二周期.在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强,据此答题.
解答 解:四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数大小顺序是a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,即X、Y处于第三周期,Z、R处于第二周期.
①离子aXm+、bYn+具有相同的电子层结构,则离子具有相同的电子数,即a-m=b-n,可得a-b=m-n,故①错误;
②由题意可知,具有相同的电子层结构,根据阴前阳后,X、Y在下一周期,Z、R在上一周期,若m>n,则Y在X的前面,R在Z的前面,所以元素的原子序数为a>b>c>d,故②正确;
③Z、R为同一周期的非金属元素,且元素的原子序数c>d,在同一周期元素非金属性从左向右在增强,即非金属性Z>R,故③正确;
④四种主族元素中X、Y为下一周期的金属元素,且元素的原子序数a>b,在同一周期元素的金属性从左向右在减弱,即金属性Y>X,则最高价氧化物对应水化物碱性Y>X,故④错误;
⑤非金属性Z>R,还原性Rm->Zn-,故⑤正确;
⑥X可以为第三周期Mg或Al,与冷水反应不反应,故⑥错误,
故选D.
点评 本题考查结构性质位置关系元素,关键明确元素在周期表中的相对位置,注意对元素周期律的理解掌握,难度中等.

| A. | 苯、甲苯、环己烷 | B. | 苯、苯酚、己烯 | ||
| C. | 乙醇、甲苯、硝基苯 | D. | 乙醇、乙醛、乙酸 |
| A. |  根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的氧化性 | |
| B. |  根据右侧小试管中液面的变化,可以判断铁钉发生了析氢腐蚀 | |
| C. |  测定中和热 | |
| D. |  根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)?N2O4(g)是一个放热反应 |
| A. | HCl和KCl | B. | H2S和Na2S | C. | CH4和H2O | D. | H2SO4和Na2SO4 |
| A. | 元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构 | |
| B. |  的核磁共振氢谱中有四组峰值1:2:2:3 的核磁共振氢谱中有四组峰值1:2:2:3 | |
| C. | 通过红外线光谱图分析可以区分乙醇和乙酸乙酯 | |
| D. | 质谱法和紫外光谱法不属于测定有机物组成和结构的现代分析方法 |
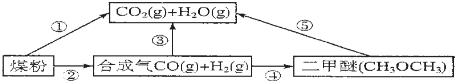

 .
. 3,4-二甲基-庚烷.
3,4-二甲基-庚烷. ,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.
,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.