题目内容
5.配制一定物质的量浓度的稀盐酸,结果偏高的是( )| A. | 在容量瓶中定容时,俯视刻度线 | |
| B. | 用量筒量取浓盐酸时,俯视刻度线 | |
| C. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线 |
分析 根据c=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
解答 解:A.在容量瓶中定容时,俯视刻度线,则所配溶液的体积偏小,所以溶液的浓度偏高,故A选;
B.用量筒量取浓盐酸俯视读数会导致液体体积偏小,溶质的物质的量偏小,所配制溶液浓度偏低,故B不选;
C.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,会有少量的溶质残留在烧杯和玻璃棒上,则容量瓶中溶质的物质的量偏小,所配制溶液浓度偏低,故C不选;
D.摇匀后见液面下降,为正常现象,如再加水至刻度线,会导致溶液体积偏大,浓度偏低,故D不选.
故选A.
点评 本题考查配制一定物质的量浓度的溶液的误差分析,题目难度中等,注意根据C=$\frac{n}{V}$计算不当操作对n或V的影响,侧重于考查学生的分析能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
15.用固体样品配制一定物质的量浓度的溶液,下列图示对应的有关操作规范的是( )
| A. |  称量 称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
16.现有下列4组物质:
A.NaOH、Ca(OH)2、SO2、Fe(OH)3
B.Cl2、C、S、Cu
C.Hg、Cu、Zn、H2
D.H2O、HCl、H2SO4、HNO3
(1)填写下列空白:
(2)4组物质中都属于电解质的是D(填序号).
(3)写出实验室制备Cl2的离子方程式为MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;.
A.NaOH、Ca(OH)2、SO2、Fe(OH)3
B.Cl2、C、S、Cu
C.Hg、Cu、Zn、H2
D.H2O、HCl、H2SO4、HNO3
(1)填写下列空白:
| A组 | B组 | C组 | D组 | |
| 分类标准 | 碱 | 常温下为固体 | 金属单质 | 酸 |
| 不属于该类别的物质 | SO2 | Cl2 | H2 | H2O |
(3)写出实验室制备Cl2的离子方程式为MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;.
13.下列各组物质按酸、混合物、碱顺序排列的是( )
| A. | 空气、硫酸铜、硫酸 | B. | 乙酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、蔗糖水、氢氧化铁 |
20.物质的量浓度均为1mol/L的下列电解质溶液各取10mL混合后,pH小于7的是( )
| A. | Ba(OH)2、NaHSO4 | B. | Na2CO3、HNO3 | C. | NaHCO3、AlCl3 | D. | NaOH、CH3COOH |
17.下列关于常见物质的工业冶炼说法正确的是( )
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业炼铁:需要用到的原料有铁矿石、一氧化碳、空气和石灰石 | |
| C. | 冶炼镁:将六水合氯化镁晶体在一定条件下加热得到无水氯化镁,电解熔融氯化镁,可以得到金属镁 | |
| D. | 生物炼铜法:利用某种能耐受铜盐毒性的细菌,这种细菌利用空气中的填氧气氧化硫化铜矿石,把不溶性的硫化铜直接转化为单质铜 |
19.某化学兴趣小组选择苯来提取碘水溶液中碘的理由中,不必要的是( )
| A. | 碘易溶于苯 | |
| B. | 苯不溶于水 | |
| C. | 苯比水轻 | |
| D. | 碘在苯中溶解度大于其在水中溶解度 |
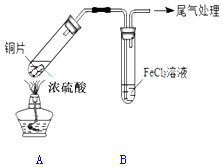 某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应
某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应