题目内容
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛.
(1)下面是利用氮气的一种途径: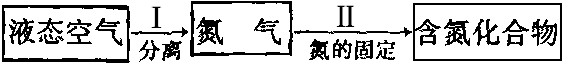
过程Ⅱ的化学方程式是______.
(2)氨气的制备与运输过程中都有严格要求.
①合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释______.
②运输时,严禁与卤素(如Cl2)混装运输.若二者接触时剧烈反应产生白烟,且0.4mol NH3参加反应时有0.3mol e-转移.写出反应的化学方程式______.
③工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O 4NH3+3O2
4NH3+3O2
通入N2的一极是______(填“阴极”或“阳极”),阳极的电极反应式是______.
(3)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1316kJ/mol
氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料:
①能利用该反应设计成电池的原因是______.
②燃料电池的负极反应式是______.
 2NH3或N2+O2
2NH3或N2+O2 2NO,
2NO,故答案为:N2+3H2
 2NH3或N2+O2
2NH3或N2+O2 2NO;
2NO;(2)①该反应正反应放热,则升高温度平衡向逆反应方向移动,氨气的产率降低,
故答案为:合成氨的反应是一个放热反应,升高温度,平衡向生成氮气和氢气的方向移动,从而使氨气的产率降低;
②氨气和氯气发生反应:8NH3+3Cl2=6NH4Cl+N2,产生白烟,且0.4molNH3参加反应时有0.3mole-转移,
故答案为:8NH3+3Cl2=6NH4Cl+N2;
③阴极N2得到电子,化合价升高,发生还原反应,阳极OH-失去电子发生氧化反应:4OH--4e-=O2↑+2H2O,故答案为:阴极;4OH--4e-=O2↑+2H2O;
(3)①该反应为自发的、放热的氧化还原反应,所以能利用该反应设计成电池,
故答案为:该反应为自发的、放热的氧化还原反应;
②根据负极失去电子,化合价升高,发生氧化反应:2NH3-6e-+6OH-=N2↑+6H2O,
故答案为:2NH3-6e-+6OH-=N2↑+6H2O.
分析:(1)根据氮的固定是将空气中游离态的氮转化为含氮化合物的过程,以及氮气的化学性质来分析;
(2)①根据温度对化学平衡的影响;
②根据氨气和氯气发生反应:8NH3+3Cl2=6NH4Cl+N2,产生白烟,且0.4molNH3参加反应时有0.3mole-转移;
③根据电解时阴极物质得到电子,化合价升高,发生还原反应,阳极物质失去电子发生氧化反应;
(3)①根据任何自发的氧化还原反应都可以设计成原电池;
②根据负极失去电子,化合价升高,发生氧化反应.
点评:本题主要考查了氮的固定、化学平衡移动原理、氧化还原反应、电极反应的书写,难度中等.

氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质
的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。

③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:

①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH = ―1316 kJ/mol,则该燃料电池的负极反应式是 。


 4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。
4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。 