题目内容
【题目】结合元素周期表,完成下列问题。
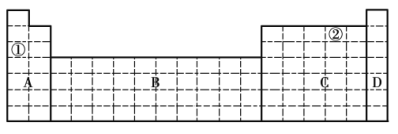
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a. A b. B c. C d. D
(2)有人认为形成化合物最多的元素不是第IVA族的碳元素,而是另一种短周期元素,请根据学过的化学知识判断这一元素是______(填元素符号)。
(3)①和②元素形成的两种常见化合物的化学式分别为______、______,它们都是______(填“共价化合物”或“离子化合物”)。
(4)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外M层与K层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置______。
②甲、乙两元素中,金属性较强的是______(填元素名称),可以验证该结论的实验有______(填序号)。
a. 将在空气中放置已久的这两种元素的块状单质分别放入热水中
b. 将这两种元素的单质粉末分别和相同浓度的盐酸反应
c. 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d. 比较这两种元素的气态氢化物的稳定性
【答案】b H ![]()
![]() 离子化合物
离子化合物  镁 be
镁 be
【解析】
(1)A区为金属元素、非金属元素共同存在的区域;B区元素为过渡元素,全部为金属元素;C区为金属元素、非金属元素共同存在的区域;D区元素为零族元素(或稀有气体元素),故选:b;
(2)碳、氢两元素均可形成无机物、有机物,且碳、氢是形成有机物的主要元素,但是在无机物中,碳形成的化合物没有氢形成的化合物多,故答案为:H;
(3)①和②元素分别是Na元素,O元素,形成的化合物分别是![]() ,
,![]() ,均属于离子化合物,故答案为:
,均属于离子化合物,故答案为:![]() ;
;![]() ;离子化合物;
;离子化合物;
(4) ①根据题意可知,甲为A1元素,乙为Mg元素,填写在元素周期表中对应的位置如下图:

②根据题意可知,甲为A1元素,乙为Mg元素;同周期元素随原子序数的递增,金属性逐渐减弱,故Mg的金属性较强,验证该结论的依据是金属性较强的元素的单质更容易与![]() 或酸反应放出
或酸反应放出![]() ,故选:bc。
,故选:bc。

【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与水反应剧烈;钠与乙醇反应平缓 | 羟基中氢的活泼性:H2O> C2H5OH |
A. AB. BC. CD. D
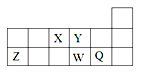
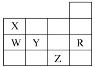
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
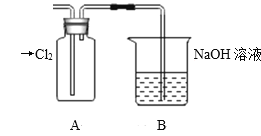
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。