题目内容
【题目】碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:

(1)已知:![]()
![]()
请写出![]() 燃烧热的热化学方程式: ______ .
燃烧热的热化学方程式: ______ .
(2)在不同温度下反应![]() 的平衡常数K如下表:
的平衡常数K如下表:
温度 | 600 | 750 | 900 | 1100 | 1250 |
平衡常数K |
|
| 1 |
|
|
①该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
②900℃时发生上述反应,![]() 的转化率随时间变化如图所示,若到达平衡后加压,则
的转化率随时间变化如图所示,若到达平衡后加压,则![]() 的转化率将
的转化率将![]() 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同![]() ______,正反应速率将 ______. 其他条件相同时,请在图中画出
______,正反应速率将 ______. 其他条件相同时,请在图中画出![]() 时
时![]() 的转化率随时间变化的示意图______.
的转化率随时间变化的示意图______.
③在![]() 时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是
时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是![]() 填编号
填编号![]() ______ ,平衡后与C中各物质的百分含量相等的组有 ______
______ ,平衡后与C中各物质的百分含量相等的组有 ______ ![]() 填编号
填编号![]()
A | B | C | D | E | |
| 3 | 1 | 0 | 1 | 1 |
| 2 | 1 | 0 | 1 | 2 |
| 1 | 2 | 3 |
| 3 |
| 5 | 2 | 3 |
| 1 |
(3)以二甲醚![]() 、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
①假设该燃料电池中盛有![]()
![]() KOH溶液,放电时参与反应的氧气在.
KOH溶液,放电时参与反应的氧气在.
②标准状况下的体积为![]() ,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
【答案】![]()
![]() 不变 增大
不变 增大 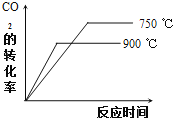 AD BD
AD BD ![]()
![]()
【解析】
![]() 已知:
已知:![]()
![]()
依据盖斯定律计算,![]() 得到,
得到,![]() ;
;
![]() 依据图中平衡常数随温度变化关系判断反应的热效应;
依据图中平衡常数随温度变化关系判断反应的热效应;
![]() 反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
![]() ,降低温度反应速率减慢,达到平衡用的时间变长,平衡正向移动,二氧化碳转化率提高,据此作图;
,降低温度反应速率减慢,达到平衡用的时间变长,平衡正向移动,二氧化碳转化率提高,据此作图;
![]() 依据图表数据可知
依据图表数据可知![]() ,平衡常数为:1,即
,平衡常数为:1,即![]() ,要使反应向正向进行则满足
,要使反应向正向进行则满足![]() ,根据乘积的比值判断反应方向;
,根据乘积的比值判断反应方向;
![]() 前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时,
前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时,
平衡后与C中各物质的百分含量相等;
![]() 先写出燃料电池的总反应式,再写出正极的电极反应式,做差得负极电极反应式;
先写出燃料电池的总反应式,再写出正极的电极反应式,做差得负极电极反应式;
![]() 计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据
计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据![]() 与
与![]() 比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断。
比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断。
![]() :
:![]()
![]()
依据盖斯定律计算,![]() 得到,
得到,![]() ;
;
热化学方程式为:![]() ;
;
故答案为:![]()
![]() ;
;
![]() 化学平衡体系中升高温度平衡向吸热反应方向移动,依据图中数据可知,温度升高,平衡常数减小,可知正向为放热反应,逆向为吸热反应,所以该反应的
化学平衡体系中升高温度平衡向吸热反应方向移动,依据图中数据可知,温度升高,平衡常数减小,可知正向为放热反应,逆向为吸热反应,所以该反应的![]() ;
;
![]() 反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
![]() ,降低温度反应速率减慢,达到平衡用的时间变长平衡正向移动,二氧化碳转化率提高,转化率随时间变化的示意图为:
,降低温度反应速率减慢,达到平衡用的时间变长平衡正向移动,二氧化碳转化率提高,转化率随时间变化的示意图为:
 ;
;
故答案为:不变;增大; ;
;
![]() 依据图表数据可知
依据图表数据可知![]() ,平衡常数为:1,即
,平衡常数为:1,即![]() ,要使反应向正向进行则满足
,要使反应向正向进行则满足![]() ,
,
A.![]() 反应向着正向移动,故A正确;
反应向着正向移动,故A正确;
B.![]() ,反应向逆向进行,故B错误;
,反应向逆向进行,故B错误;
C.![]() ,反应向逆向进行,故C错误;
,反应向逆向进行,故C错误;
D.![]() ,反应向正向进行,故D正确;
,反应向正向进行,故D正确;
E.![]() ,反应向逆向进行,故E错误;
,反应向逆向进行,故E错误;
故选:AD;
![]() 前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时, 平衡后与C中各物质的百分含量相等,将各组物质转化为初始为二氧化碳和氢气投料, C中
前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时, 平衡后与C中各物质的百分含量相等,将各组物质转化为初始为二氧化碳和氢气投料, C中![]() :
:![]() 为:3:
为:3:![]() :1;
:1;
A.![]() :
:![]() 为:4:3与C组不相等,故A错误;
为:4:3与C组不相等,故A错误;
B.![]() :
:![]() 为:3:3与C组不相等,故B正确;
为:3:3与C组不相等,故B正确;
D.![]() :
:![]() 为:
为:![]() :
:![]() 与C组相等,故D正确;
与C组相等,故D正确;
E.![]() :
:![]() 为:2:3与C组不相等,故E错误;
为:2:3与C组不相等,故E错误;
故选:BD;
故答案为;AD;BD;
![]() 二甲醚、空气、KOH溶液为原料总电池反应方程式为:
二甲醚、空气、KOH溶液为原料总电池反应方程式为:![]()
正极电极反应式为:![]()
![]() 得:
得:![]() ;
;
故答案为:![]() ;
;
![]() 参与反应的氧气在标准状况下体积为8960mL,物质的量为
参与反应的氧气在标准状况下体积为8960mL,物质的量为![]() ,根据电子转移守恒可知,生成二氧化碳为
,根据电子转移守恒可知,生成二氧化碳为![]() ;
; ![]() ,
,![]() :
:![]() :
:![]() :1, 发生反应
:1, 发生反应![]() ,二者恰好反应生成碳酸钾,在
,二者恰好反应生成碳酸钾,在![]() 溶液中
溶液中![]() ,
,![]() ,
,![]() ,
,![]() 水解使溶液呈碱性,有
水解使溶液呈碱性,有![]() ;由于
;由于![]() 少部分水解,有
少部分水解,有![]() ,
,![]() 又发生第二步水解,有
又发生第二步水解,有![]() ,第二步水解较第一步水解弱的多,那么
,第二步水解较第一步水解弱的多,那么![]() 、
、![]() 相差不大,但
相差不大,但![]() 比
比![]() 小的多,因此
小的多,因此![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,
,
故答案为:![]()

 名题金卷系列答案
名题金卷系列答案【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
【题目】下表为25℃的三种弱酸的电离平衡常数:
化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________。
(3)写出NaA溶液中通少量CO2的离子方程式____________________。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:

①如上图所示,试管④中装入的固体应该是_________(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______(填“强”或“弱”)。
【题目】在25℃时,固定容积的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.2 | 0.1 | 0.1 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.2 |
A. 反应可表示为3X+Y ![]() 2Z
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 达平衡后,X、Y浓度分别增加0.35 mol·L-1和0.15 mol·L-1,平衡正移,X的转化率变小
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则v正>v逆