题目内容
已知氧化性:Cl2>IO3—>Fe3+>I2,以下实验的结论或实验的预测合理的是( )
| A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I- |
| B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色 |
| C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有IO3— |
| D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成 |
C
解析

练习册系列答案
相关题目
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。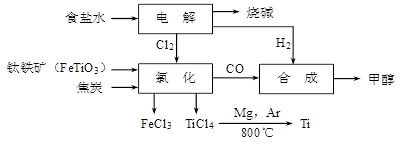
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下: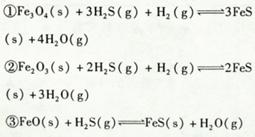
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是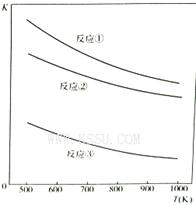
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
下列化学应用中不涉及氧化还原反应的是
| A.Na2S水溶液在空气中变浑浊 |
| B.生活中使用明矾净水,除去水中的悬浮颗粒 |
| C.溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D.漂白粉漂白有色布条 |
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O32—与Cl2反应的产物之一为SO42—。下列说法中,错误的是( )
| A.该反应中的氧化剂是Cl2 |
| B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42—,可脱去2 mol Cl2 |
| D.根据该反应可判断还原性:S2O32—>Cl- |
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为( )
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32-是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应时有10 mol电子转移 |
C.产物中的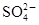 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |