题目内容
【题目】富铁铝土矿![]() 主要含有
主要含有![]() 、
、![]() 、FeO和
、FeO和![]() 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁![]() 研究发现,当
研究发现,当![]() 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下![]() 部分操作和产物略
部分操作和产物略![]() :
:
![]()
![]() 与
与![]() 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
![]() 测得滤液中
测得滤液中 加入
加入![]() 和
和![]() 的作用是
的作用是![]() 结合化学用语说明
结合化学用语说明![]() ______ .
______ .
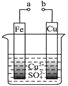
![]() 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示![]() 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极![]()

![]() 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
![]() 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
【答案】![]()
![]() ,补充
,补充![]()
![]() 减小 电解过程中反应室中的
减小 电解过程中反应室中的![]() 通过阴离子交换膜进入阳极室,阴极室中的
通过阴离子交换膜进入阳极室,阴极室中的![]() 通过阴离子交换膜进入反应室,生成聚合硫酸铝铁
通过阴离子交换膜进入反应室,生成聚合硫酸铝铁
【解析】
铝土矿![]() 含
含![]() 及少量
及少量![]() 和FeO、
和FeO、![]() ,加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣为二氧化硅和不溶性杂质,滤液中加入绿矾晶体补充亚铁离子并利用过氧化氢氧化为铁离子,最后利用电解原理得到液体聚全硫酸铝铁,据此分解解题;
,加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣为二氧化硅和不溶性杂质,滤液中加入绿矾晶体补充亚铁离子并利用过氧化氢氧化为铁离子,最后利用电解原理得到液体聚全硫酸铝铁,据此分解解题;
![]() 氧化铝是两性氧化物溶于强酸强碱,与硫酸反应生成硫酸铝和水;
氧化铝是两性氧化物溶于强酸强碱,与硫酸反应生成硫酸铝和水;
![]() 滤液中
滤液中 ,新型净水剂液体聚合硫酸铝铁
,新型净水剂液体聚合硫酸铝铁![]() ,当
,当![]() 时净水效果最好,故需要增加溶液里
时净水效果最好,故需要增加溶液里![]() 的浓度;
的浓度;
![]() 阴极上氢离子得电子生成氢气;
阴极上氢离子得电子生成氢气;
![]() 电解过程中阳极发生氧化反应,水电离的
电解过程中阳极发生氧化反应,水电离的![]() 失电子被氧化为氧气,促进水的电离;
失电子被氧化为氧气,促进水的电离;
![]() 阴离子交换膜只允许阴离子通过,则阴极室中的氢氧根离子进入反应室生成
阴离子交换膜只允许阴离子通过,则阴极室中的氢氧根离子进入反应室生成![]() .
.
![]() 硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:
硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 因滤液中
因滤液中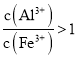 ,加入绿矾晶体引入
,加入绿矾晶体引入![]() ,并利用过氧化氢氧化得到
,并利用过氧化氢氧化得到![]() ,补充溶液里的
,补充溶液里的![]() ,使
,使 ,其中氧化
,其中氧化![]() 的离子反应式为
的离子反应式为![]() ,故答案为:
,故答案为:![]() ,补充
,补充![]() ;
;
![]() 阴极上氢离子得电子生成氢气,则阴极的电极反应式为:
阴极上氢离子得电子生成氢气,则阴极的电极反应式为:![]() ;
;
![]() 阳极上水电离的
阳极上水电离的![]() 被氧化,促进水的电离,阳极周围溶液里
被氧化,促进水的电离,阳极周围溶液里![]() 浓度增大,溶液的pH减小,故答案为:减小;
浓度增大,溶液的pH减小,故答案为:减小;
![]() 阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成
阴离子交换膜只允许阴离子通过,电解过程中反应室中的氯离子通过阴离子交换膜进入阳极室,阴极室中的氢氧根离子进入反应室生成![]() ;故答案为:电解过程中反应室中的
;故答案为:电解过程中反应室中的![]() 通过阴离子交换膜进入阳极室,阴极室中的
通过阴离子交换膜进入阳极室,阴极室中的![]() 通过阴离子交换膜进入反应室,生成聚合硫酸铝铁.
通过阴离子交换膜进入反应室,生成聚合硫酸铝铁.

 阅读快车系列答案
阅读快车系列答案【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
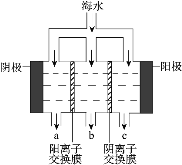
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
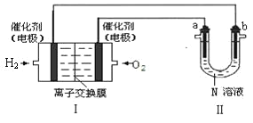
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
【题目】物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是
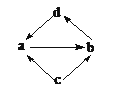
选项 | a | b | c | d |
A | SO2 | SO3 | S | H2SO4 |
B | Na2O | Na2O2 | Na | NaOH |
C | CO | CO2 | C | H2CO3 |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.AB.BC.CD.D