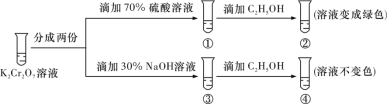
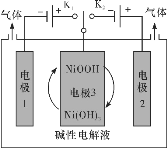
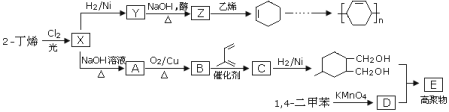
题目内容
【题目】一定条件下,在水溶液中1 mol Cl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。D是____(填离子符号)。B→A+C的热化学方程式为____________(用离子符号表示)。
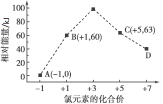
【答案】ClO4- 3ClO-(aq)=2Cl-(aq)+ClO3-(aq) △H=117kJ/mol
【解析】
由图可知,D中Cl元素的化合价为+7价,B→A+C结合转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,结合图中能量变化计算反应热。
由图可知,D中Cl元素的化合价为+7价,则D为ClO4;B→A+C结合转移电子守恒得该反应方程式为3ClO=ClO3+2Cl,△H=(63kJ/mol+2×0kJ/mol)3×60kJ/mol=117kJ/mol,所以该热化学反应方程式为3ClO(aq)=ClO3 (aq)+2Cl(aq)△H=117kJ/mol。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下达平衡后,增大压强平衡不移动
B.该反应方程式可表示为:X+2Y=3W
C.升高温度,若W的体积分数减小,则此反应ΔH>0
D.恒温恒容时,增加X的物质的量,平衡向正向移动,X的转化率提高