题目内容
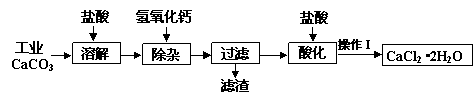
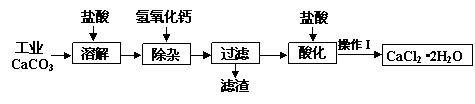
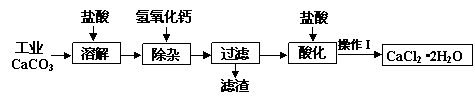
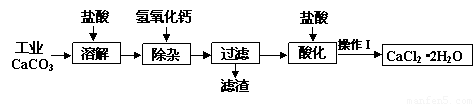
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:

(1)CaCO3与盐酸反应的离子方程式 ▲ 。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣
主要成分的化学式为 ▲ ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 ▲ 。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 ▲ 。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ▲ ⑤ ▲ 等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL
0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为 ▲ 。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 ▲ 引起的(填序号),理由是 ▲ 。
(1)CaCO3+2H+=Ca2++CO2↑+H2O(1分)
(2)①Al(OH)3、SiO2、Fe(OH)3(1分)NaCl(1分)
(3)除去过量的氢氧化钙(1分,合理则给分);
(4)洗涤;干燥(各1分)
(5)①.102.5﹪(2分)
②.⑤(1分) ;干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目