题目内容
18.一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为( )| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过浓H2SO4时,浓H2SO4的作用是吸收水分,浓H2SO4增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的物质的量,根据二者质量可计算CO的物质的量,进而计算还需要O2体积.
解答 解:当其缓缓通过足量浓H2SO4时,浓硫酸增重14.4g,则水的质量为14.4g,
n(H2O)=$\frac{14.4g}{18g/mol}$=0.8moL,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=0.4mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.4mol,
又:m(CO)+m(CO2)=30.4g-14.4g=16g,
则:n(CO)×28g/mol+(0.4mol-n(CO))×44g/mol=16g,
解之得:n(CO)=0.1mol,
根据:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,
此甲烷完全燃烧还需要O2体积为:0.05mol×22.4L/mol=1.12L,
故选A.
点评 本题考查混合物的计算,题目难度不大,注意从质量守恒的角度解答该题.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
8.下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是( )
| A. | 可燃性气体的验纯 | |
| B. | 实验剩余的药品不能放回原试剂瓶 | |
| C. | 滴管不能交叉使用 | |
| D. | 盛装氢氧化钠的试剂瓶不能用玻璃塞 |
9.2008年5月12日我国四川发生了里氏8.0级地震,为了实现大灾之后无大疫,消防人员用大量的含氯制剂对灾民居住环境进行了消毒,其中“84消毒液”成为明星消毒液.“84消毒液”的有效成分是( )
| A. | 氯气 | B. | 次氯酸 | C. | 次氯酸钙 | D. | 次氯酸钠 |
6.下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸与稀氨水反应:H++OH-=H2O | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 碘化钾溶液在酸性条件下被氧气氧化:4I-+O2+4H+=2I2+2H2O | |
| D. | 二氧化氮与水反应:2NO2+2H2O=2H-+2NO3-+H2 |
13.下列化合物的分子中,所有原子均处于同一平面的是( )
| A. | 丙烯 | B. | 氯乙烷 | C. | 甲苯 | D. | 溴苯 |
3.下列说法正确的是( )
| A. | 离子化合物中一定不含共价键 | |
| B. | 共价化合物中一定不含离子键 | |
| C. | 两种元素组成的化合物中一定不含非极性键 | |
| D. | 氢键只存在于分子之间 |
10.下列图象能正确反映其对应关系的是( )
| A. | 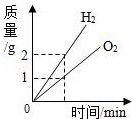 电解水生成氢气和氧气的质量与反应时间的关系 | |
| B. | 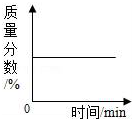 加热一定量高锰酸钾固体制氧气,剩余固体中锰元素的质量分数与反应时间的关系 | |
| C. | 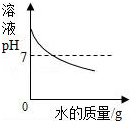 向氢氧化钠溶液中不断加水,溶液PH与加入水的质量关系 | |
| D. | 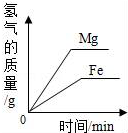 相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系 |
7.已知自然界氧的同位素有16O、17O、18O,水中氢的同位素有H、D,从水分子的原子组成来看,自然界的水分子可以有( )
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
1.常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=1.4×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17.下列有关说法中,错误的是( )
| A. | 常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱 | |
| B. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 | |
| C. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 | |
| D. | 因为AgCl比Ag2SO4更难溶,所以AgCl不会转化为Ag2SO4 |