题目内容
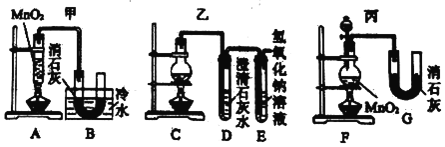
【题目】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________,装置C中三颈瓶置于冰水浴中的目的是______________________。
(2)装置B吸收的气体是____________(写化学式),装置D的作用是____________________。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。
【答案】分液漏斗 防止Cl2与KOH反应生成KClO3 HCl 吸收多余的Cl2,防止污染空气 3C1O-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 置于冰水浴中,加入适量饱和KOH溶液 94.3
【解析】
由反应原理和实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收。
(1)根据装置图可知仪器a的名称是分液漏斗,Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,故答案为:分液漏斗;防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气,故答案为:HCl;吸收多余的Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥,故答案为:置于冰水浴中,加入适量饱和KOH溶液;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×![]() ×198g/mol×10=0.198g,所以K2FeO4样品的纯度为
×198g/mol×10=0.198g,所以K2FeO4样品的纯度为![]() ×100%=94.3%,故答案为:94.3。
×100%=94.3%,故答案为:94.3。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|