题目内容
已知温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mLb mol•L-1的一元碱BOH充分混合,下列判断一定正确的是
A.若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化
B.若pH(HA)+ pH(BOH)=14,则V1=V2时,酸碱恰好完全中和
C.此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-)
D.若混合溶液中c(OH-)=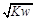 mol•L-1,则此溶液一定呈中性
mol•L-1,则此溶液一定呈中性
【答案】
D
【解析】
试题分析:A、若二者为强酸强碱盐溶液稀释H+和OH-浓度不会变,错误;B、若二者为强酸强碱,则表述正确,若为一强一弱,则弱的溶液会过量,错误;C、因为c(H+)前的系数是2,该等式应该是小于而不能等于;D、当c(OH-)= mol•L-1时,必有c(OH-)= c(H+),溶液为中性,正确。
mol•L-1时,必有c(OH-)= c(H+),溶液为中性,正确。
考点定位:考查了溶液的PH值计算,溶液中守恒关系等知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol?L?1的一元酸HA与b mol?L?1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol?L?1 mol?L?1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH?)+c(A?) |
 mol/L
mol/L