题目内容
【题目】合理利用和转化PCl5、NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)已知:P4(s) + 6Cl2(g) = 4PCl3(g) △H1= c kJmol-1
P4(s) +10Cl2(g) = 4PCl5(g) △H2= d kJmol-1
PCl3、PCl5分子的结构如图,其中实线表示化学键。若断开PCl5分子中1mol P-Cl键,平均消耗x kJ的能量,断开PCl3中1mol P-Cl键消耗1.2x kJ的能量。
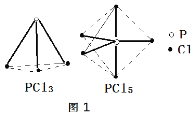
①写出PCl3与Cl2反应的热化学方程式_______。(热值用c、d表示)
②断开1mol的Cl-Cl键消耗的能量为________。
(2)NOx的排放主要来自于汽车尾气,利用反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH = -34.0 kJmol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) ΔH = -34.0 kJmol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
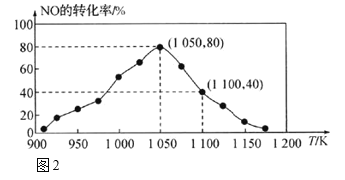
①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,其原因是_______;在1100K时,CO2的体积分数为___。
②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________。[已知:气体分压P分=气体总压(P总)×气体物质的量分数]
(3)反应N2O4(g)![]() 2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
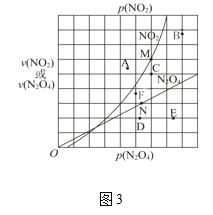
①在T℃时,图3中M、N点能表示该反应达到平衡状态,理由是________。
②改变温度,υ(NO2)会由M点变为A、B或C,υ(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,NO2和N2O4相对应的点分别是___、 ___(填字母)
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图4所示。
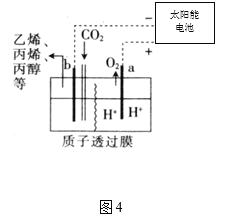
①a极发生________(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为________。
【答案】Cl2(g)+PCl3(g)=PCl5(g) ΔH =![]() kJmol-1
kJmol-1 ![]() kJ 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% 4 M点 υ(NO2)是N点υ(N2O4)的2倍,符合方程式系数比,所以该反应的正反应速率等于逆反应速率 B F 氧化 2CO2+12H++12e-=C2H4+4H2O
kJ 1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% 4 M点 υ(NO2)是N点υ(N2O4)的2倍,符合方程式系数比,所以该反应的正反应速率等于逆反应速率 B F 氧化 2CO2+12H++12e-=C2H4+4H2O
【解析】
⑴①根据盖斯定律,第2个方程式减去第1个方程式,再除以4,得到PCl3与Cl2反应的热化学方程式。
②断开1mol的Cl-Cl键消耗的能量为a,则a + 1.2xkJ×3 - xkJ×5 = ![]() kJ,解得a =
kJ,解得a = ![]() kJ。
kJ。
⑵①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,1050K时,反应达到平衡,1050K之前没有达到平衡,正在建立平衡的阶段,转化率随温度升高而增大,在1100K时,该反应是等体积反应,假设NO物质的量为1mol,NO转化率为40%,消耗0.4mol,剩余0.6mol,生成氮气和二氧化碳分别为0.2mol,则CO2的体积分数为![]() 。
。
②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,在1050K时,该反应是等体积反应,假设NO物质的量为1mol,NO转化率为80%,消耗0.8mol,剩余0.2mol,生成氮气和二氧化碳分别为0.4mol,该反应的化学平衡常数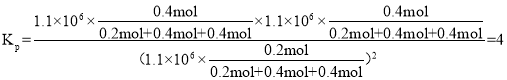 。
。
⑶①在T℃时,图3中M、N点能表示该反应达到平衡状态,M点υ(NO2)是N点υ(N2O4)的2倍,符合方程式系数比,所以该反应的正反应速率等于逆反应速率,因此达到平衡。
②改变温度,升高温度,正逆反应速率都加快,平衡向吸热反应移动即生成二氧化氮的方向移动,二氧化氮浓度大,压强增大,四氧化二氮浓度减小,因此υ(NO2)会由M点变为B点,υ(N2O4)会由N点变为F。
⑷①a极为阳极,发生氧化反应。
②电解时,b极上二氧化碳得到电子生成乙烯的电极反应为2CO2+12H++12e=C2H4+4H2O。
⑴①根据盖斯定律,第2个方程式减去第1个方程式,再除以4,得到PCl3与Cl2反应的热化学方程式Cl2(g)+PCl3(g)=PCl5(g) ΔH =![]() kJmol-1,故答案为:Cl2(g)+PCl3(g) = PCl5(g) ΔH =
kJmol-1,故答案为:Cl2(g)+PCl3(g) = PCl5(g) ΔH =![]() kJmol-1。
kJmol-1。
②断开1mol的Cl-Cl键消耗的能量为a,则a + 1.2xkJ×3 - xkJ×5 = ![]() kJ,解得a =
kJ,解得a = ![]() kJ,故答案为:
kJ,故答案为:![]() kJ。
kJ。
⑵①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,1050K时,反应达到平衡,1050K之前没有达到平衡,正在建立平衡的阶段,转化率随温度升高而增大,在1100K时,该反应是等体积反应,假设NO物质的量为1mol,NO转化率为40%,消耗0.4mol,剩余0.6mol,生成氮气和二氧化碳分别为0.2mol,则CO2的体积分数为![]() ,故答案为:1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
,故答案为:1050K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大;20%。
②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,在1050K时,该反应是等体积反应,假设NO物质的量为1mol,NO转化率为80%,消耗0.8mol,剩余0.2mol,生成氮气和二氧化碳分别为0.4mol,该反应的化学平衡常数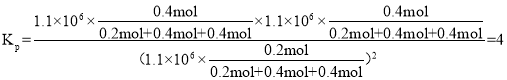 ,故答案为:4。
,故答案为:4。
⑶①在T℃时,图3中M、N点能表示该反应达到平衡状态,M点υ(NO2)是N点υ(N2O4)的2倍,符合方程式系数比,所以该反应的正反应速率等于逆反应速率,因此达到平衡,故答案为:M点υ(NO2)是N点υ(N2O4)的2倍,符合方程式系数比,所以该反应的正反应速率等于逆反应速率。
②改变温度,升高温度,正逆反应速率都加快,平衡向吸热反应移动即生成二氧化氮的方向移动,二氧化氮浓度大,压强增大,四氧化二氮浓度减小,因此υ(NO2)会由M点变为B点,υ(N2O4)会由N点变为F,故答案为:B、F。
⑷①a极为阳极,发生氧化反应,故答案为:氧化。
②电解时,b极上二氧化碳得到电子生成乙烯的电极反应为2CO2+12H++12e=C2H4+4H2O,故答案为:2CO2+12H++12e=C2H4+4H2O。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________ (填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH______8.3(填“>”“<”或“=”,下同),说明甲同学正确;若_______8.3,说明乙同学正确。
【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)滴定终点的判断:溶液由_____________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(_____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为_________mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
第二次 | 25.00 | 0.56 | 30.30 | |
第三次 | 25.00 | 0.20 | 26.35 | |
②依据上表数据计算该NaOH溶液的物质的量浓度________ (计算结果取4位有效数)。