题目内容
【题目】自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。
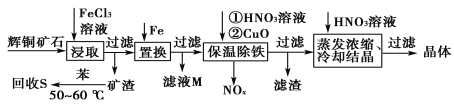
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①H2S的电子式为_________________________________。
②第二步反应中SO2体现_____________性。(填“氧化”或“还原”)
③总反应的化学方程式为_________________________。
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g) ![]() 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。
①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是 _______, (NH4)2SO4溶液呈酸性的原因是__________ (用离子方程式表示)。
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中![]() , 则Ksp(BaSO4)=__________[已知Ksp(BaSO3)= 5×10-7]
, 则Ksp(BaSO4)=__________[已知Ksp(BaSO3)= 5×10-7]
【答案】![]() 氧化 2H2+SO2
氧化 2H2+SO2![]() S
S![]() +2H2O 温度过高,(NH4)2SO3会分解,(NH4)2SO3浓度减少,反应速率减少
+2H2O 温度过高,(NH4)2SO3会分解,(NH4)2SO3浓度减少,反应速率减少 ![]()
![]()
【解析】
(1)①根据电子式步骤书写分析;第二步反应是H2S和SO2反应生成S和H2O,根据化合价进行分析;③氢气与二氧化硫总反应生成硫单质和水。
(2)①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,主要考虑温度过高,(NH4)2SO3会分解,(NH4)2SO4溶液呈酸性的原因是铵根水解显酸性;②根据 进行计算。
进行计算。
(1)①H2S的电子式为![]() ;故答案为:
;故答案为:![]() 。
。
②第二步反应是H2S和SO2反应生成S和H2O,反应中SO2中S化合价降低,体现氧化性;故答案为:氧化。
③氢气与二氧化硫总反应生成硫单质和水,因此总反应的化学方程式为2H2+SO2![]() S
S![]() +2H2O;故答案为:2H2+SO2
+2H2O;故答案为:2H2+SO2![]() S
S![]() +2H2O。
+2H2O。
(2)①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是温度过高,(NH4)2SO3会分解,(NH4)2SO3浓度减少,反应速率减少,(NH4)2SO4溶液呈酸性的原因是铵根水解显酸性,其离子方程式为![]() ;故答案为:温度过高,(NH4)2SO3会分解,(NH4)2SO3浓度减少,反应速率减少;
;故答案为:温度过高,(NH4)2SO3会分解,(NH4)2SO3浓度减少,反应速率减少;![]() 。
。
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液, , 则Ksp(BaSO4)=1×1010,故答案为:1×1010。
, 则Ksp(BaSO4)=1×1010,故答案为:1×1010。