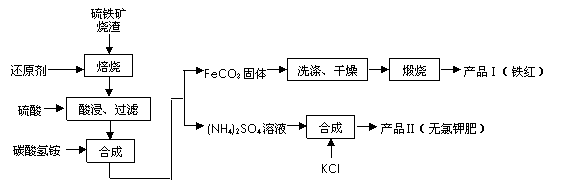
题目内容
工业制硫酸生产流程如下图:

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
(3)在生产中,为提高催化剂效率采取了哪些措施?
(4)已知2SO2(g)+O2(g)![]() 2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是________________________________________。
2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是________________________________________。
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。
(1)黄铁矿为原料的生产中产生的废弃物太多,处理成本高
(2)C、D
(3)①净化气体 ②控制温度在400~500℃ ③增大催化剂与反应气体的接触面积
(4)①<,在1atm和298K条件下,2mol SO2和1mol O2完全反应生成2mol SO3,放出196kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为450℃,所以放出的热量小于196kJ
(5)93.4%
(6) ![]()

(10分)工业制硫酸生产流程如下图:
|

(1)造气阶段,为提高反应的效率,充分利用含硫矿石,请你提出两条可行的措施:
、
|
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1
 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
A.平衡向逆反应方向移动了
B.SO2的转化率减小了
C.SO3的质量分数增加了
D.平衡移动过程中,v(逆)< v(正)
(3)在催化反应室,发生(2)中的反应,已知:某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答:
①将1.0mol SO2和0.05mol O2置于10L密闭容器中,反应达平衡后,若体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B) (填“>”、“<”或“=”)。
(4)增大体系的压强能使(2)中平衡向正反应方向移动,但在实际生产中采用了常压的条件,你认为可能的原因是: 。