题目内容
15.在密闭容器中发生如下反应:mA(g)+nB(g)═pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
分析 平衡后将气体体积缩小到原来的一半,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,逆向是气体体积减小的反应,根据平衡移动原理分析.
解答 解:平衡后将气体体积缩小到原来的一半,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,
A、增大压强平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n<p,故A正确;
B、由上述分析可知,增大压强平衡向逆反应方向移动,故B错误;
C、增大压强平衡向逆反应方向移动,则反应物的转化率降低,故A的转化率降低,故C正确;
D、平衡向逆反应移动,生成物的体积百分含量降低,即C的体积分数降低,故D错误.
故选:AC.
点评 本题考查化学平衡移动的影响,题目难度不大,本题注意用假定法判断,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,根据实际C的浓度,判断平衡移动.

练习册系列答案
 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
5.针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )

| A. | 在Ag催化下与O2反应时,①、③键断裂 | B. | 分子间脱水时,①②键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | D. | 与醋酸、浓硫酸共热时,②键断裂 |
6.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )
| A. | 两种元素原子的电子层上全部都是s电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 | |
| D. | M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子 |
3.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 检验工业废水中是否含有苯酚 | 在试管中加入2 mL工业废水样品,然后加入2滴浓溴水,振荡,观察是否产生白色沉淀 |
| B | 验证乙醛中含有醛基 | 在试管中加入2 mL10%的CuSO4溶液,然后加入4至6滴2%的NaOH溶液振荡,再加入0.5 mL乙醛溶液加热煮沸,观察是否出现红色沉淀 |
| C | 提纯粗苯甲酸 | 将1g粗苯甲酸溶于50mL蒸馏水,加热使之全部溶解,趁热过滤,将滤液冷却结晶,滤出晶体 |
| D | 证明溴乙烷发生消去反应生成乙烯 | 将产生的气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
10.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
20.下列化工生产原理错误的是( )
①可以用电解熔融的氯化铝的方法来制取金属铝
②可以用钠加入氯化镁饱和溶液中制取镁
③用热分解法冶炼铁
④湿法炼铜是用锌和硫酸铜溶液反应置换出铜.
①可以用电解熔融的氯化铝的方法来制取金属铝
②可以用钠加入氯化镁饱和溶液中制取镁
③用热分解法冶炼铁
④湿法炼铜是用锌和硫酸铜溶液反应置换出铜.
| A. | ②③ | B. | ①③ | C. | ①②③ | D. | ①②③④ |
7.对现代元素周期表的提出做出最重要贡献的科学家是( )
| A. | 门捷列夫(俄国) | B. | 纽兰兹(英国) | C. | 迈耶尔(德国) | D. | 拉瓦锡(法国) |
4.下列关于原子的几种描述中,正确的是( )
| A. | 硫的原子结构示意图: | |
| B. | Be2+离子中的质子数和电子数之比为2:1 | |
| C. | 原子核内有8个中子的碳原子:${\;}_{8}^{14}$C | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
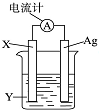 依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题: